Ceped Formuły ciepła, jak je obliczyć i rozwiązane ćwiczenia

- 1012
- 283
- Maksymilian Kępa
On Ceded Heat Jest to przenoszenie energii między dwoma ciałami w różnych temperaturach. Ten, który jest wyższą temperaturą, daje ciepło tym, którego temperatura jest niższa. Niezależnie od tego, czy ciało daje lub pochłania ciepło, jego temperatura lub stan fizyczny mogą się różnić w zależności od masy i charakterystyki materiału, którego jest wytwarzane.
Dobrym przykładem jest filiżanka parującej kawy. Łyżka metalu, z którą cukier jest mieszany. Jeśli pozostanie w filiżance wystarczająco dużo czasu, zakończy się kawa i metalowa łyżeczka. Pewne ciepło przekroczy środowisko, ponieważ system nie jest izolowany.
 Kawa i łyżeczka stają się przez chwilę w równowadze termicznej. Źródło: Pixabay.
Kawa i łyżeczka stają się przez chwilę w równowadze termicznej. Źródło: Pixabay. Kiedy temperatury są dopasowane, Równowaga termiczna.
Gdyby ten sam test został wykonany za pomocą plastikowej łyżeczki, z pewnością zauważyłoby, że nie nagrzewa się tak szybko jak metal, ale ostatecznie stanie się również w równowadze z kawą i wszystkim, co ją otacza.
Jest tak, ponieważ metal prowadzi ciepło lepiej niż plastik. Z drugiej strony z pewnością kawa daje ciepło w innym tempie niż gorąca czekolada lub inny napój. Następnie ciepło przypisane lub wchłaniane przez każdy obiekt zależy od tego, który materiał lub substancja jest wytwarzana.
[TOC]
Co jest i formuły
Ciepło zawsze odnosi się do przepływu lub tranzytu energii między jednym obiektem a drugim, ze względu na różnicę temperatury.
Dlatego mówi się o ciepło przypisanym lub pochłanianym ciepło, ponieważ poprzez dodanie lub wydobywanie ciepła lub energii w jakiś sposób możliwe jest zmodyfikowanie temperatury elementu.
Zazwyczaj nazywa się to ilością ciepła, jak najgorętszy obiekt daje. Ta wartość jest proporcjonalna do masy wspomnianego obiektu. Ciało o wielkiej masie jest w stanie zrezygnować z więcej ciepła niż inne mniejsze masy.
Może ci służyć: Millikan Experiment: Procedura, wyjaśnienie, znaczenieRóżnica temperatur Δt
Kolejnym ważnym czynnikiem w obliczeniach przypisanego ciepła jest różnica temperatury, jaką doświadcza obiekt, który daje ciepło. Jest oznaczony jako δT I jest obliczane w ten sposób:
ΔT = tF - Talbo
Wreszcie, ilość przypisanego ciepła zależy również od natury i charakterystyki obiektu, które są podsumowane ilościowo w stałej nazwie Ciepło specyficzne, oznaczone jako C.
Wreszcie wyrażenie przypisanego ciepła jest następujące:
QSceding = - m.C.ΔT
Wydajność jest symbolizowana znakiem ujemnym.
Pojemność ciepła i ciepła substancji
Ciepło właściwe jest ilością ciepła niezbędnego do podniesienia temperatury 1 g substancji o 1 ° C. Jest to wewnętrzna właściwość materiału. Jego jednostki w systemie międzynarodowym to: Joule/kg . K (Joule między kilogramem x temperatura w stopniach Kelvin).
Pojemność cieplna C jest powiązaną, ale nieco inną koncepcją, ponieważ masa obiektu interweniuje. Pojemność cieplna jest zdefiniowana w następujący sposób:
C = MC
Jego jednostki w s.Siema. To są dżul/k. Tak, aby ciepło Ceded można było również wyrazić równoważnie jako:
Q = -C. ΔT
Jak to obliczyć?
Aby obliczyć ciepło przypisane przez obiekt, należy znać następujące:
- Ciepło właściwe substancji, które nadaje ciepło.
- Masa wspomnianej substancji
- Końcowa temperatura do uzyskania
Wartości ciepła dla wielu materiałów zostały określone eksperymentalnie i są dostępne w tabelach.
Kalorymetria
Teraz, jeśli ta wartość nie jest znana, możliwe jest jej uzyskanie za pomocą termometru i wody w termicznie izolowanym pojemniku: kalorymetrze. Schemat tego urządzenia pokazano na rysunku, które towarzyszy ćwiczeniu 1.
Próbka substancji jest zanurzona w określonej temperaturze w ilości wody, która wcześniej mierzona. Ostateczna temperatura jest mierzona, a przy uzyskanych wartości określono ciepło właściwe materiału.
Może ci służyć: błąd losowy: wzór i równania, obliczenia, przykłady, ćwiczeniaPorównując wynik z wartościami tabelowanymi, można wiedzieć, jaka to substancja. Ta procedura jest wywoływana kalorymetria.
Bilans cieplny odbywa się przez ochronę energii:
Q Sceding + Q Absorbowane = 0
Rozwiązane ćwiczenia
Ćwiczenie 1
0 kawałek 0.35 kg w temperaturze 150 ° C w 500 ml wody w temperaturze 25 ° C. Znajdować:
a) końcowa temperatura równowagi
b) Ile płynie ciepła w tym procesie?
Dane
Cmiedź = 385 J/kg . ºC
CWoda = 4180 J/kg . ºC
Gęstość wody: 1000 kg/m3
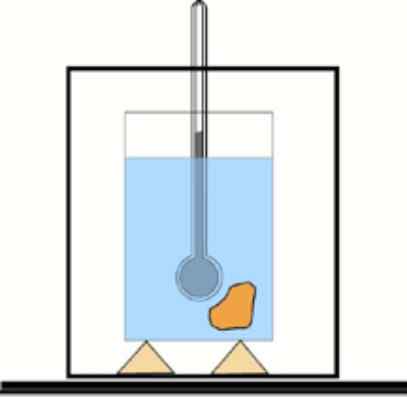 Podstawowy schemat kalorymetru: pojemnik z izolowaną wodą i termometr do pomiaru zmian temperatury. LFIENTE: DR. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Podstawowy schemat kalorymetru: pojemnik z izolowaną wodą i termometr do pomiaru zmian temperatury. LFIENTE: DR. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Rozwiązanie
a) Miedź daje ciepło, podczas gdy woda go wchłania. Ponieważ system jest uważany za zamknięty, tylko woda i próbka interweniują w równowadze ciepła:
Q Sceding = Q zaabsorbowany
Z drugiej strony konieczne jest obliczenie masy 500 ml wody:
500 ml = 0.5 l = 0.0005 m3
Z tymi danymi obliczana jest masa wody:
Masa = gęstość x objętość = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Równanie cieplne jest podniesione w każdej substancji:
QSceding = -Mmiedź . Cmiedź. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ° C) = -134.75 (tF - 150) J
Qzaabsorbowany = mwoda . Cwoda. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Wyrównanie wyników:
2093 (tF - 25) = -134.75 (tF - 150)
Jest to równanie liniowe z nieznanym, którego rozwiązaniem jest:
TF = 32.56 ° C
b) Ilość przepływu ciepła to przypisane ciepło lub pochłaniane ciepło:
Q Sceding = - 134.75 (32.56 - 150) J = 15823 J
Q zaabsorbowany = 2093 (32.56 - 25) J = 15823 J
Ćwiczenie 2
Miedziany kawałek 100 g jest ogrzewany w piekarniku do temperatury talbo A następnie zostaje wprowadzony do miedzianego kalorymetru 15 g, który zawiera 200 g wody w 16 ° C. Końcowa temperatura raz w równowadze wynosi 38 ° C. Kiedy kalorymetr i jego zawartość są ważone, okazuje się, że 1 odparował.2 g wody, jaka była temperatura początkowa talbo?
Może ci służyć: dziura robaka: historia, teoria, typy, formacjaDane: Ułożenie ciepła waporyzacji wody wynosi lv = 2257 kJ/kg
Rozwiązanie
Ćwiczenie to różni się od poprzedniej, ponieważ należy uznać, że kalorymetr również pochłania ciepło. Ciepło przypisane przez kawałek miedzi jest inwestowane we wszystkie następujące:
- Podgrzej wodę z kalorymetru (200 g)
- Podgrzej miedź, której kalorymetr jest wytwarzany (150 g)
- Odparuj 1.2 gramy wody (dla zmiany fazowej potrzebujesz również energii).
QSceding = -100 X 1 x 10 -3 kg. 385 J/kg . ºC. (38 - Talbo ) ºC = -38.5. (38 - Talbo) J
Q wchłonięty przez niego kalorymetr = Q wchłonięte przez wodę + Q odparowanie + Q wchłonięte przez miedź
0.2 kg .4186 J/kg ºC .(38 - 16 ° C) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ° C) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Dlatego:
-38.5. (38 - Talbo) = 22397.3
Talbo = 619.7 ° C
Ciepło niezbędne do przeniesienia 1 można było również rozważyć.2 g wody do 100 ° C, ale jest to dość niewielka ilość w porównaniu.
Bibliografia
- Giancoli, zm. 2006. Fizyka: zasady z aplikacjami. 6th. Wyd. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizyka: spojrzenie na świat. 6ta Skrócone wydanie. Cengage Learning. 156 - 164.
- Rex, a. 2011. Podstawy fizyki. osoba. 309 - 332.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z nowoczesną fizyką. 14th. Wyd. Tom 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Podstawy fizyki. 9na Cengage Learning.
- « Ustalona koncepcja ciepła, formuły i ćwiczenia
- Definicja platformy czynnikowej, formuły i ćwiczenia »

