Struktura kalmoduliny, funkcje i mechanizm działania
- 1619
- 72
- Prokul Woliński
Calmodulin Jest to termin, który oznacza „białko zmyane wapniem” i odnosi się do małego białka wewnątrzkomórkowego, które jest właścicielem właściwości jonu wapnia (Ca ++) i w celu pośredniczenia w wielu jego działaniu wewnątrzkomórkowym. Pochodzenie tego słowa rodzi się z kombinacji angielskich słów „wapń”, „modulowany” i „białko”, które, gdy razem pochodzi z LIMONKACiium ModułAted ProteW.
Wśród elementów mineralnych, które stają się częścią konstytucji organizmów zwierzęcych, wapń, a następnie fosfor, różni się znacznie od najbardziej obfitej, ponieważ kość powstaje w wyniku osadzania w matrycy dużych ilości soli mineralnych utworzonych z tego jon.
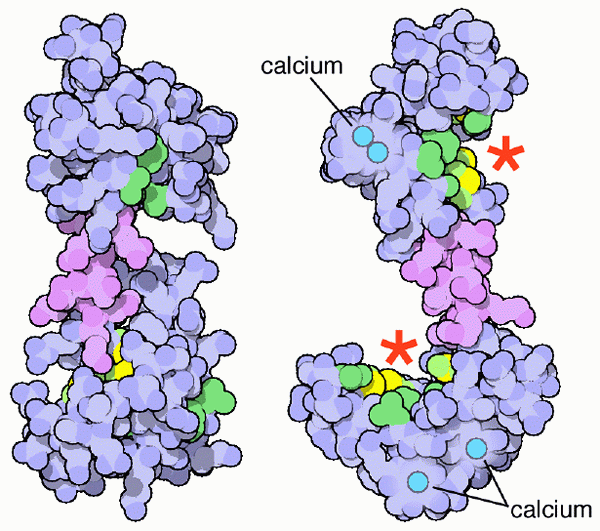
 Schemat kalmoduliny i jego miejsca wapnia (źródło: PDB [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Schemat kalmoduliny i jego miejsca wapnia (źródło: PDB [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Oczywiście te sole mineralne wapnia są niezbędne do konstytucji i konformacji układu szkieletowego kręgowców, ale to jonizowana postać wapnia (Ca ++) w roztworze w płynach ustrojowych staje się fizjologicznym znaczeniem istotnym dla żywotności całego życia życie organizmów.
Kation ten, z dwoma dodatnimi ładunkami elektrycznymi w swojej strukturze, może działać jako aktualny przenośnik podczas poruszania się przez błonę komórkową i modyfikować jego poziom potencjału elektrycznego w wielu pobudliwych komórkach organizmu, głównie w mięśniu sercowym.
Ale o większym znaczeniu fizjologicznym jest fakt, że wiele komórkowych reakcji regulacyjnych wystrzelonych przez bodźce zewnętrzne, takie jak neuroprzekaźniki, hormony lub inne czynniki fizyczne lub biochemiczne, jest gatunkami wodospadów metabolicznych, w których kilka białek uczestniczyło sekwencyjnie, z których niektóre są enzymami, które są enzymami, które są enzymami to enzymy, które są enzymami, wymagają wapnia do aktywacji lub inaktywacji.
Następnie mówi się w tych przypadkach, że wapń działa jako drugi posłańca w metabolicznym wodospadzie mającego na celu uzyskanie ostatecznego wyniku, który stałby się niezbędną reakcją komórkową, aby zaspokoić potrzebę wykryte na innym poziomie niż sama komórka, i wymaga od niej ta szczególna odpowiedź.
Wapń może działać bezpośrednio na swoim biochemicznym celu, aby wpłynąć na jego aktywność, ale często wymaga uczestnictwa białka, z którym musi być zjednoczone, aby móc wywierać wpływ na białko (. Kalmodulina jest jednym z tych pośredniczących białek.
[TOC]
Struktura
Kalmodulina, o wielkiej wszechobecności, ponieważ jest wyrażana w prawie wszystkich typach komórek eukariotycznych, jest to małe białko kwasowe o masie cząsteczkowej około 17 kDa, którego struktura jest wyjątkowo zachowana wśród gatunków.
Może ci służyć: Kanały jonowe: struktura, funkcje, typyJest to monomeryczne białko, to znaczy powstrzymywane przez pojedynczy łańcuch polipeptydowy, który przyjmuje na jego końcowych końców. Każda domena kulisty ma dwa powody znane jako EF Hand (z angielskiego Ef Ręka), które są typowe dla białek wiążących się z wapniem.
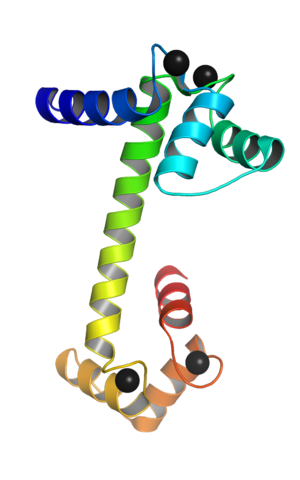 Kalmodulina powiązana z jonami wapnia (źródło: Webridge [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Kalmodulina powiązana z jonami wapnia (źródło: Webridge [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Te motywy topologiczne „EF” reprezentują rodzaj struktur supersecundarii; Są one ze sobą powiązane, w każdej domenie kulistych, przez region o dużej elastyczności i w każdym z nich istnieje miejsce połączenia dla Ca ++, które rzuca 4 miejsca dla każdej cząsteczki kalmoduliny.
Związek jonów wapnia, z dodatnim obciążeniem, jest możliwe dzięki obecności odpadów aminokwasowych z łańcuchami bocznymi ujemnie naładowanymi w miejscach wapnia wapnia kalmoduliny. To odpady to trzy asparty i glutaminian.
Funkcje kalmoduliny
Wszystkie dotychczasowe funkcje znane z kalmoduliny są otoczone w grupie działań promowanych przez wzrost wapnia cytozolowego wytwarzanego przez jego wejście z przestrzeni pozakomórkowej lub jego wyjście ze złóż wewnątrzkomórkowych: mitochondria i retikulum endoplazmatyczne.
Wiele działań wapnia jest wypełnione przez ten jon działający bezpośrednio na białe białka, które mogą mieć różnorodną naturę i funkcje. Nie można bezpośrednio wpływać na niektóre z tych białek, ale wymagają, aby wapń przyłączył się do kalmoduliny i to kompleks działa na białko pod wpływem jonu.
Mówi się o tych białych białkach, które są zależnymi kalmoduliną wapnia, a wśród nich dziesiątki enzymów, takie jak białka, białkofosfaza, cykllesy nukleotydowe i fosfodiesterazy; Wszyscy zaangażowani w niezliczone funkcje fizjologiczne, które obejmują:
- Metabolizm
- Transport cząstek
- Mobilność trzewna
- Wydzielanie substancji
- Owule zapłodnienia
- Ekspresja genetyczna
- Proliferacja komórek
- Integralność strukturalna komórek
- Komunikacja międzykomórkowa itp.
Wśród białek zależnych od kalmoduliny są cytowane: kinaz lekki miozyny (MLCK), fosforylaza cynowa i Ca ++/calmodulin Cinasas I, II i III.
Zatem informacje kodowane przez sygnały wapnia (wzrost lub spadek stężenia wewnątrzkomórkowego) są „rozszyfrowane” przez to i inne białka zjednoczenia wapnia, które czynią sygnały zmiany biochemiczne; Innymi słowy, kalmodulina jest pośredniego białka w procesach sygnalizacyjnych zależnych od wapnia.
Może ci służyć: Glut 2: Charakterystyka, struktura, funkcjeMechanizm akcji
Kalmodulina jest bardzo wszechstronnym białkiem, ponieważ jego „docelowe” białka są znacznie zróżnicowane w formie, sekwencji, wielkości i funkcji. Ponieważ jest to białko, które działa jako „czujnik” jonów wapnia, jego mechanizm działania zależy od zmian indukowanych w jego strukturze i/lub konformacji, gdy dołączy do czterech z tych jonów.
Jego mechanizmy działania można zilustrować, krótko przeglądając ich udział w kilku procesach fizjologicznych, takich jak skurcz mięśni gładkich i adaptacja do zapachów, które cierpią przez komórki nosa błony śluzowej węchu w nosie.
Skurcz kalmoduliny i mięśni gładkich
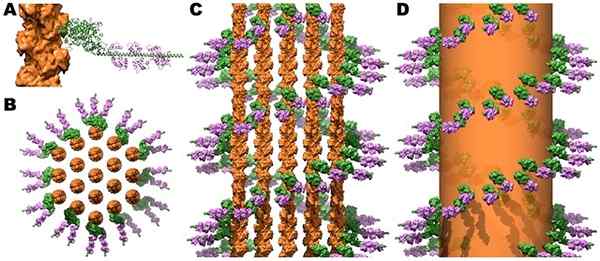 Struktura mostów krzyżowych miozyny i kalmoduliny w mikroidelozyjnych wiązkach aktyny. Źródło: Jeffrey W. Brown, c. James McKnight [CC przez (https: // creativeCommons.Org/licencje/według/3.0)]
Struktura mostów krzyżowych miozyny i kalmoduliny w mikroidelozyjnych wiązkach aktyny. Źródło: Jeffrey W. Brown, c. James McKnight [CC przez (https: // creativeCommons.Org/licencje/według/3.0)] Skurcz mięśni szkieletowych i sercowych jest wyzwalany, gdy wzrost cytozolowej Ca ++ osiąga poziomy powyżej 10-6 mol/l, a jon ten wiąże się z troponiną C, co ulega zmianom w Osteric, które wpływają. Z kolei tropomiozyna porusza się i ujawnia w aktywach swoich miejsc związkowych z miozyną, uzyskując, że proces skurczowy wywołuje.
W mięśniach gładkich nie ma troponiny C, a wzrost Ca ++ powyżej wskazanego poziomu promuje jego związek z kalmoduliną. Kompleks Ca-Calmodulin Active to Light Chain Cinase of Myozyna (MLCK), który z kolei fosforyluje do tego łańcucha lekkiego, aktywuje miozynę i uruchamia proces skurczowy.
Wzrost Ca ++ jest podawany przez jego wejście z zewnątrz lub wyjście z retikulum sarkoplazmatycznego przez działanie tryfosforanu inozytolu (IP3) uwalnianego przez fosfolipazę C w wodospadzie aktywowanym przez receptory sprzężone z białkiem GQ sprzężonym z białkiem GQ. Relaksowanie występuje, gdy Ca ++, poprzez działanie transportowe, jest usuwane z cytosolu i wraca do miejsc źródłowych.
Ważną różnicą między obiema rodzajami skurczu jest to, że w prążkowanych mięśniach (serca i szkieletowych) Ca ++ indukuje zmiany Alestharical podczas łączenia jego białka, troponina, podczas gdy w gładkiej zmiany powodowane przez kalmodulinę Ca są kowalencyjne i implikowane sugeruje fosforylację miozyny.
Dlatego po zakończeniu akcji Ca ++ wymagane jest udział innego enzymu, który usuwa fosforan dodany przez Cinasę. Ten nowy enzym jest fosfatazą lekkiego łańcucha miozyny (MLCP), której aktywność nie zależy od kalmoduliny, ale jest regulowany przez inne drogi.
W rzeczywistości skurczowy proces mięśni gładkich nie ustaje, ale stopień skurczu jest utrzymywany na poziomie pośredniego, co wynika z równowagi działań obu enzymów, MLCK kontrolowanego przez Ca ++ i kalmodulinę, a MLCP przekazany innym kontrole regulacyjne.
Może ci służyć: pachyneAdaptacja w czujnikach węchowych
Zapachowe odczucia wywołuje, gdy aktywowane są receptory węchowe znajdujące się w rzęskach komórek znajdujących się na powierzchni błony śluzowej węchowej.
Receptory te są sprzężone z heterotroficznym białkiem G znanym jako „golf” (białko węchowe), które ma trzy podjednostki: „αolf”, „ß” i „γ”.
Gdy receptory węchowe są aktywowane w odpowiedzi na zapach, podjednostki tego białka są zdysocjowane, a podjednostka „αolf” aktywuje enzym adenylocyklazy, wytwarzając cykliczny monofosforan adenozyny (AMPC).
AMPC aktywuje kanały typu CNG (aktywowane przez cykliczne nukleotydy) dla wapnia i sodu. Jony te dostają się do komórki, depolaryzują ją i powodują początek potencjałów czynnościowych, których częstotliwość określi intensywność zapachu.
Wapń, który wchodzi, który ma tendencję do depolaryzacji komórki, ma antagonistyczne działanie negatywnego sprzężenia zwrotnego, nieco później, przyłączając się do kalmoduliny i między nimi zamykając kanał i eliminowanie bodźca depolaryzującego, pomimo faktu, że bodźca zapachowy utrzymuje się. Nazywa się to adaptacja czujnika.
Kalmodulina w roślinach
Rośliny reagują również na różnice stężenia wewnątrzkomórkowego od jonów wapnia za pomocą białka kalmoduliny. W tych organizmach kalmoduliny mają wiele cech strukturalnych i funkcjonalnych ze swoimi odpowiednikami u zwierząt i drożdży, chociaż różnią się niektórymi aspektami funkcjonalnymi.
Na przykład kalmodulina w roślinach łączy krótkie sekwencje peptydowe w swoich białych białkach, indukując zmiany strukturalne, które zmieniają ich aktywność w odpowiedzi na wewnętrzne zmiany wapnia.
W jakim stopniu kalmodulina kontroluje w roślinach analogiczne procesy, do których występują u zwierząt, jest czymś, co nadal jest przedmiotem dyskusji.
Bibliografia
- Brenner B: Musculatur, w: Fizjologia, 6. edycja; R Klinke i in. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: molekularne podstawy fizjologii medycznej, w: w: Przegląd fizjologii medycznej, 25. edycja. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Wprowadzenie do endokrynologii, w: Podręcznik fizjologii medycznej, 13th Ed, AC Guyton, Je Hall (red.). Philadelphia, Elsevier Inc., 2016.
- KAUP UB, Müller F: System Olfactorisches, IN: Physiologie, edycja 4; P Deetjen i in. (Eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle Als Grundbaustein, w: Fizjologia, 6. edycja; R Klinke i in. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zieliński, r. I. (1998). Białka wiążące kalmodulinę i kalmodulinę w roślinach. Coroczny przegląd biologii roślin, 49 (1), 697-725.

