Historia bromo, struktura, konfiguracja elektroniczna, właściwości,

- 1336
- 174
- Paweł Malinowski
On brom Jest to element niemetaliczny, który należy do grupy halogenów, grupa 17 (viia) stolika okresowego. Jego chemicznym symbolem jest BR. Jest przedstawiony jako cząsteczka dwuatomiczna, której atomy łączą się z wiązaniem kowalencyjnym, więc wzór molekularny jest przypisany2.
W przeciwieństwie do fluoru i chloru, brom w warunkach naziemnych nie jest gazem, ale czerwonawo -brązową cieczą (niższy obraz). Pali i jest razem z rtęcią, jedynymi płynnymi elementami. Poniżej jod, chociaż jego kolor nasila się i staje się fioletowy, może krystalizować w niestabilnym stałym.
 Fiolka z czystym bromem ciekłym. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Fiolka z czystym bromem ciekłym. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Bromo odkryto niezależnie w 1825 r. Przez Carla Löwiga, który studiował pod kierunkiem niemieckiego chemika Leopolda Gmelina; Aw 1826 r. Przez francuskiego chemika Antoine-Jerome Ballard. Jednak publikacja eksperymentalnych wyników Balarda poprzedziła spektakl Löwig.
Bromo to 62 najliczniejszy element na ziemi, rozmieszczony w niskich stężeniach przez korę Ziemi. W morzu średnie stężenie wynosi 65 ppm. Ciało ludzkie zawiera 0,0004 % bromu, a nie ostatecznie znając jej funkcjonowanie.
Ten element jest wykorzystywany komercyjnie w Salmuelas lub w miejscach, w których w specjalnych warunkach znajdują się wysokie sole; Na przykład Morze Martwe, do których zbiegają się wody sąsiednich terytoriów, nasycone solami.
Jest to element żrący zdolny do atakowania metali, takich jak platyna i paladowe. Rozpuszczony w wodzie, brom może również wywierać swoje żrące działanie na ludzkie tkanki, pogarszając sytuację, ponieważ można wygenerować kwas bromhyterowy. Jeśli chodzi o jego toksyczność, może powodować ważne uszkodzenie narządów, takich jak wątroba, nerki, płuca i żołądek.
Brom jest bardzo szkodliwy w atmosferze, jest 40-100 razy bardziej destrukcyjny dla warstwy ozonowej niż chlor. Połowa utraty warstwy ozonowej na Antarktydzie jest wytwarzana przez reakcje związane z bromometylem, związkiem stosowanym jako fumigant.
Ma wiele zastosowań, takich jak: opóźnienie przeciwpożarowe, środek wybielający, środki dezynfekujące powierzchnię, dodatek paliwa, pośrednik w produkcji uspokajającej, w produkcji chemikaliów organicznych itp.
[TOC]
Historia
Carl Löwig Praca
Bromo został odkryty niezależnie i prawie jednocześnie przez Carla Jacoba Löwiga, niemieckiego chemika w 1825 r., Oraz przez Antoine Balard, francuski chemik w 1826 roku.
Carl Löwig, uczeń niemieckiego chemika Leopolda Gmelina, zebrał wodę ze sprężyny złego Kreuznacha i dodał chlor; Po dodaniu eteru wymieszał mieszaninę cieczy.
Następnie eter oddzielony przez destylację i skoncentrował go przez parowanie. W rezultacie uzyskał czerwonawo -brązową substancję, która była bromem.
Praca Antoine Balard
Z drugiej strony Balard użył popiołów brązowej algi. W ten sposób uwolniony bromo, chlor przeszedł przez materiał wodny poddany ekstrakcji, w którym obecny był bromek magnezu, MGBR2.
Następnie materiał destylowano w obecności dwutlenku manganu i kwasu siarkowego, wytwarzając czerwone opary, które skondensowały się w ciemnej cieczy. Balard pomyślał, że to nowy element i nazwał go Muride, pochodzący od łacińskiego słowa muria, z którym wyznaczono solankę.
Może ci służyć: żywa materia: koncepcja, cechy i przykładyZwrócono uwagę, że Balard zmienił nazwę Muride na Brotme na podstawie sugestii Anglada lub Gay-Lussaca, w oparciu o fakt, że Bôme oznacza Pestilent, który określa zapach odkrytego elementu.
Wyniki zostały opublikowane przez Belarda w Annales of Chemie and Symique, zanim Löwig opublikował własne.
Tylko od 1858 r. Brom był wytwarzany w ważnych ilościach; rok, w którym odkryto i wykorzystano osady soli Stassfurt, uzyskując brom.
Elektroniczna struktura i konfiguracja bromo
Cząsteczka
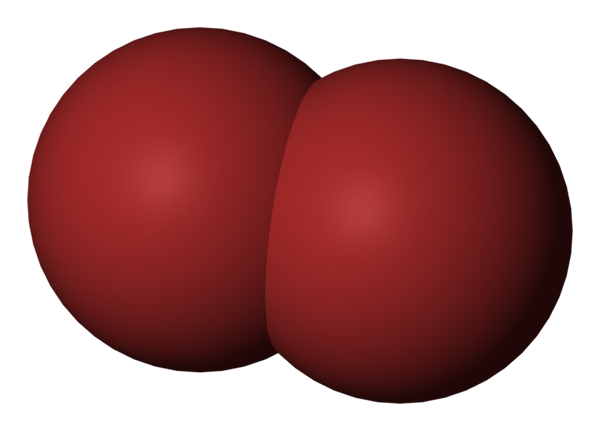 Cząsteczka BR2. Źródło: Benjah-BMM27 [domena publiczna].
Cząsteczka BR2. Źródło: Benjah-BMM27 [domena publiczna]. Na górnym obrazie pokazano cząsteczkę bromu, BR2, Z kompaktowym modelem wypełniania. W rzeczywistości istnieje proste kowalencyjne wiązanie między dwoma atomami bromu, Br Br BR.
Będąc cząsteczką dwuatomiczną i jednorodną, brakuje jej trwałego momentu dipolowego i może wchodzić w interakcje z innymi tym samym typem poprzez londyńskie siły dyspersji.
To jest powód, dla którego twój czerwonawy płyn pali; W cząsteczkach BR2, Podczas gdy są stosunkowo ciężkie, ich siły międzycząsteczkowe utrzymują je słabo połączone.
Bromo jest mniej elektroonegatywne niż chlor, a zatem wywiera niższy wpływ przyciągania na elektronę warstw Walencii. W rezultacie wymaga mniej energii, aby podróżować wyższymi poziomami energii, pochłaniając zielone fotony i odzwierciedlając czerwonawy kolor.
Kryształy
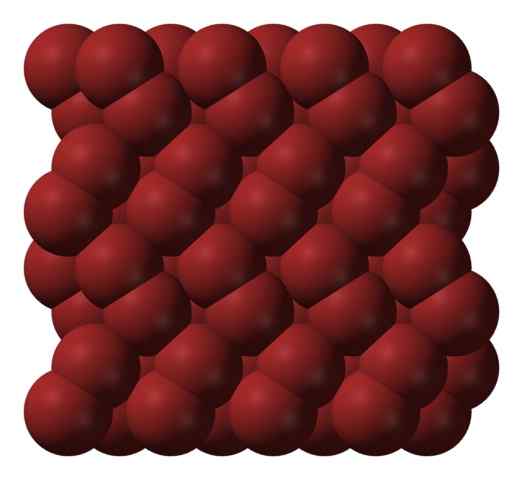 Struktura krystaliczna bromo. Źródło: Ben Mills [domena publiczna].
Struktura krystaliczna bromo. Źródło: Ben Mills [domena publiczna]. W fazie gazowej cząsteczki BR2 Oddzielają się znacznie, dopóki między nimi pojawią się wydajne interakcje. Jednak poniżej jego temperatury topnienia brom można zamrozić w czerwonawych kryształach ortorekrobnych (obraz doskonały).
Zwróć uwagę, jak cząsteczki BR2 Są uporządkowani w taki sposób, że wydają się „robakami brom”. Tutaj i w tych temperaturach (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Warstwa i stany utleniania walencji
Konfiguracja bromu elektronicznego wynosi:
[AR] 3D104s2 4p5
Będąc 3d104s2 4p5 jego warstwa walencyjna (chociaż orbital 3D10 Nie mieć znaczenia w reakcjach chemicznych). Elektrony orbitali 4S i 4p są najbardziej zewnętrzne i dodają w sumie 7, tylko jeden elektron, aby ukończyć okT w Walencji.
Z tej konfiguracji możliwe stany utleniania można wywnioskować dla brominy: -1, jeśli elektron zyskuje na izolektroniczny dla Kripton; +1, będąc jak 3D104s2 4p4; +3, +4 i +5, utrata wszystkich elektronów orbity 4p ([AR] 3D104s24p0); i +7, działający bez elektronów na orbicie 4S ([AR] 3D104s04p0).
Nieruchomości
Wygląd fizyczny
Mały ciemnobrązowy czerwonawy płyn. Występuje w naturze jako cząsteczka dwuatomiczna, z atomami zjednoczonymi kowalencyjną wiązaniem. Bromo to gęstsza ciecz niż woda i wlewa się w nią.
Może ci służyć: radio: struktura, właściwości, użycia, uzyskiwanieMasa atomowa
79 904 g/mol.
Liczba atomowa
35.
Zapach
Akrowy dym, duszący i irytujący.
Temperatura topnienia
-7,2 ° C.
Punkt wrzenia
58,8 ºC.
Gęstość (br2) płyn
3 1028 g/cm3
Rozpuszczalność wody
33,6 g/l A 25 ° C. Rozpuszczalność bromu w wodzie jest niska i ma tendencję do wzrostu przez obniżenie temperatury; Zachowanie podobne do innych gazów.
Rozpuszczalność
Swobodnie rozpuszczalny w alkoholu, eterze, chloroformu, tetrachlorku węgla, disiarczku węgla i skoncentrowanym kwasu chlorowodorowym. Rozpuszczalne w rozpuszczalnikach niebolarnych i niektórych polarnych, takich jak alkohol, kwas siarkowy i w wielu rozpuszczalnikach fluenicznych.
Potrójny punkt
265,9 K przy 5,8 kPa.
Punkt krytyczny
588 K przy 10,34 MPa.
Fusion Heat (BR2)
10 571 kJ/mol.
Ciepło parowe (BR2)
29,96 kJ/mol.
Molowa pojemność kaloryczna (BR2)
75,69 kJ/mol.
Ciśnienie pary
W temperaturze 270 K, 10 kPa.
Temperatura samowystarczalności
Nie łatwopalne.
punkt zapłonu
113 ° C.
Temperatura przechowywania
2 do 8 ° C.
Napięcie powierzchniowe
40,9 mn/m 25 ºC.
Zapach próg
0,05 - 3,5 ppm. 0,39 mg/m3
Wskaźnik refrakcji (ηd)
16083 do 20 ° C i 16478 do 25 ° C.
Elektronialiczność
2.96 na skali Pauling.
Energia jonizacji
- Pierwszy poziom: 1.139,9 kJ/mol.
- Drugi poziom: 2.103 kJ/mol.
- Trzeci poziom: 3.470 kJ/mol.
Radio atomowe
120 PM.
Radio Kowalencyjne
120.3 PM.
Van der Waals Radio
185 PM.
Reaktywność
Jest mniej reaktywny niż chlor, ale bardziej reaktywny niż jod. Jest to utleniacz mniej silny niż chlor i silniejszy niż jod. Jest to również słabszy środek redukujący niż jod, ale silniejszy niż chlor.
Para chloru jest wysoce żrący dla wielu materiałów i ludzkich tkanek. Atakuje wiele metalowych elementów, w tym platynę i paladu; Ale nie atakuje ołowiu, niklu, magnezu, żelaza, cynku i poniżej 300 ° C ani do sodu.
Bromo w wodzie doświadcza zmiany i przekształca się w bromek. Może również istnieć jako bromat (bracie3-), W zależności od płynnego pH.
Ze względu na działanie utleniające brom może indukować uwalnianie rodników pozbawionych tlenu. Są to silne utleniacze i mogą powodować uszkodzenie tkanek. Również brom może powodować spontaniczne zapłon w połączeniu z potasem, fosforem lub cyną.
Aplikacje
Dodatek benzyny
Dibromid etylenowy zastosowano do wyeliminowania możliwych złóż ołowiu w silnikach CARS. Po spalaniu benzyny, która wykorzystywała ołów jako dodatek, brom w połączeniu z ołów w celu utworzenia bromku ołowiu, lotnego gazu wydalonego przez rurkę wydechową.
Podczas gdy brom wyeliminował ołów z benzyny, jego niszczycielskie działanie na warstwie ozonowej było bardzo potężne, dlatego został odrzucony do tego zastosowania.
Pestycydy
Metylen lub brometyl bromek zastosowano jako pestycyd do oczyszczania gleb, szczególnie w celu wyeliminowania pasożytniczych nicień, takich jak Anylostome.
Jednak zastosowanie większości związków zawierających brom zostało odrzucone, ponownie destrukcyjne na warstwie ozonowej.
Kontrola wydawania rtęci
Bromo jest stosowany w niektórych roślinach w celu zmniejszenia emisji rtęci, bardzo toksycznego metalu.
Może ci służyć: grawimetria: analiza grawimetryczna, metody, zastosowania i przykładyFotografia
Srebrny bromek, oprócz srebrnego joduro i chlorku srebrnego, jest stosowany jako wrażliwy na światło związek w emulsjach fotograficznych.
Działania terapeutyczne
Bromid potasowy, a także bromek lituowy, zastosowano jako ogólne środki uspokajające w XIX wieku i na początku XX wieku. Proste sole są nadal używane w niektórych krajach, takich jak antykonwulsje.
Jednak FDA Stanów Zjednoczonych nie zatwierdza stosowania bromu w leczeniu jakiejkolwiek choroby.
Ogniarnia
Brom jest przekształcany przez płomienie w kwas bromhorowy, który zakłóca reakcję utleniania, która występuje podczas ognia, i powoduje jego ekstynkcja. Polimery zawierające brom są używane do tworzenia żywic opóźniających pożar.
Dodatek do żywności
Dodano ślady bromatu potasu w celu poprawy gotowania.
Odczynniki chemiczne i pośrednie
Bromid wodoru jest stosowany jako środek redukujący i katalizator do reakcji organicznych. Bromo jest stosowany jako chemiczny pośrednik w produkcji leków, płynów hydraulicznych, czynników czynników chłodniczych, osuszaczy i przygotowań do rozliczania włosów.
Znajduje również stosowanie w opracowywaniu płynów wiertniczych, produktów do dezynfekcji wody, białawe czynniki, środki dezynfekujące powierzchniowe, barwniki, dodatki paliwa itp.
Działanie biologiczne
Badanie przeprowadzone w 2014 r. Wskazuje, że brom jest niezbędnym kofaktorem do biosyntezy kolagenu IV, co sprawia, że brom jest niezbędnym elementem rozwoju tkanki zwierzęcych. Nie ma jednak informacji o konsekwencjach deficytu elementu.
Gdzie to się znajduje
Bromo jest wydobywane komercyjnie z kopalni soli i głębokich studni salmuuelasowych znalezionych w stanie Arkansas, oraz w wielkim słonym jeziorze Utah, oba w Stanach Zjednoczonych. Ta ostatnia solanka ma 0,5 % stężenie bromu.
Wyodrębnić brom.
Morze Martwe, na granicy Jordanii a Izraelem, to zamknięte morze, które znajduje się pod poziomem morza, co czyni go bardzo wysokim stężeniem soli.
Bromo i potass są tam uzyskiwane na rynku, przez odparowanie wody o wysokiej soli z Morza Martwego. Na tym morzu stężenie bromu może osiągnąć 5 g/l.
Występuje również w wysokich stężeniach w niektórych gorących źródłach. Na przykład Bominita to srebrny minerał bromku występujący w Boliwii i Meksyku.
Ryzyko
Brom w stanie ciekłym jest żrący dla ludzkich tkanek. Ale największe niebezpieczeństwo dla człowieka pochodzi z oparów bromowych i wdychania.
Oddychaj w środowisku o stężeniu bromu 11-23 mg/m3 Powoduje poważne wstrząsy. Stężenie 30-60 mg/m3 Jest niezwykle szkodliwy. Tymczasem stężenie 200 mg może być śmiertelne.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- National Center for Biotechnology Information. (2019). Brom. Baza danych Pubchem. CID = 23968. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Ross Rachel. (8 lutego 2017 r.). Fakty o brominie. Odzyskane z: Livescience.com
- Wikipedia. (2019). Boraks. Źródło: w:.Wikipedia.org
- Lentech b. V. (2019). Brom. Odzyskane z: lentech.com
- « Charakterystyka miozyny, struktura, typy i funkcja
- Charakterystyka nukleasów, struktura, typy i funkcje »

