Charakterystyka miozyny, struktura, typy i funkcja
- 4610
- 1050
- Marianna Czarnecki
Miozyna Jest to silnik molekularny o naturze białka, który może poruszać się na włóknach aktyny w cytosolu. Energia napędzająca przemieszczenie miozyny pochodzi z hydrolizy ATP. Z tego powodu miozyna jest zwykle definiowana jako enzym mekanochemii.
W eukariotach miozyna jest bardzo obfitym białkiem. Istnieją różne rodzaje miozyny, które są kodowane przez rodzinę genów. U drożdży wyróżnia się 5 klas, podczas gdy dziesiątki zostały opisane na ssakach.
 Źródło: David Richfield (Użytkownik: Slashme) Podczas korzystania z tego obrazu w pracach zewnętrznych można go cytować w następujący sposób: Richfield, David (2014). „Galeria medyczna David Richfield”. Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Źródło: David Richfield (Użytkownik: Slashme) Podczas korzystania z tego obrazu w pracach zewnętrznych można go cytować w następujący sposób: Richfield, David (2014). „Galeria medyczna David Richfield”. Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] Miozyna ma wiele różnych funkcji. Miozyna I, obok aktyny, uczestniczy w ruchu keratocytów.
Miozyna II zapewnia sztywność błony plazmatycznej, uczestniczy w cytokinezy i skurczu mięśni. Zarówno miozyny I i II, współpracują z migracją komórek. Miozyny I i V wykonują transport pęcherzyków wzdłuż włókien aktynowych.
[TOC]
Struktura
W mikrografach elektronicznych typowa struktura izoform miozyny ma trzy domeny: głowę, szyję i ogon. Poprzez hydrolizę z chimotrypsyną, otrzymuje się segment składający się z głowy i szyi, zwany ciężką meromiozyną (HMM) i segment ogona zwany lekką meromiozyną (LMM).
Mistrzostwo głowy to N-końcowy koniec łańcucha ciężkiego, a domeną ogona jest C-końcowy koniec łańcucha lekkiego.
Klasy miozyny można różnicować liczbą łańcuchów polipeptycznych, które je komponują, a także liczebność i klasa łańcucha lekkiego zjednoczone wokół.
Miozyna I ma łańcuch polipeptydowy, który tworzy głowę, a jej ogon brakuje regionów ślubnych alfa. Podczas gdy miozyny ja i V mają dwa łańcuchy polipeptydowe i tam.
Myosinas I i V mają miejsca związkowe do Calmidulin, która reguluje i naprawia CA+2, W łańcuchach lekkich. Miozina, którą naprawiłem CA+2 W lekkich łańcuchach, ale robi to inaczej niż kalmodulina.
Charakterystyka
Na poziomie mechanicznym miozyny mają trzy cechy, a mianowicie:
- Głowa miozyny jest domeną motoryczną, która rozwija dyskretne kroki: Związek miozyny udaje się do filamentu aktyny, jego skłonność i późniejsza separacja wytwarzają ruch miozyny. Ten proces jest cykliczny i zależy od ATP.
- Zmiany konformacji: Hydroliza cząsteczki ATP jest sprzężona na każdym etapie cząsteczki miozyny, za pomocą poziomów amplifikacji i przesyłania. To implikuje duże zmiany konformacyjne miozyny.
Może ci służyć: symetria promieniowaPierwszy poziom amplifikacji jest wytwarzany przez utratę grupy gamma-fosforan ATP, co umożliwia reorganizację elementów strukturalnych w miejscu Unii ATP. Ta reorganizacja jest skoordynowana ze zmianami strukturalnymi w terenie Unii do aktyny.
Drugi poziom wzmocnienia implikuje komunikację zmiany konformacyjnej w miejscu aktywnym z komponentami strukturalnymi terminalnego karboksylu.
- Kierunkowość: Stwierdzono, że moja ma polaryzację lub odwrotną kierunkowość, pod koniec (+) filamentu aktynowego. Wniosek pochodzi z eksperymentów wyrównania filamentu aktyny, przy użyciu mikroskopu optycznego fluorescencyjnego.
Funkcje
Miozyna, obok aktyny, uczestniczy w skurczu mięśni, adhezji komórkowej, cytokinezy, przyznając sztywność błon korowych i przemieszczenie niektórych pęcherzyków, między innymi.
Wady miozyny mogą wytwarzać warunki patologiczne. Na przykład wady miozynów I i V są odpowiednio powiązane z miopatią z zaburzeń miozyny i pigmentacji (zespół Griselli). Podczas gdy zaburzenia izoform miozyny VI powodują utratę ucha.
Skurcz mięśnia
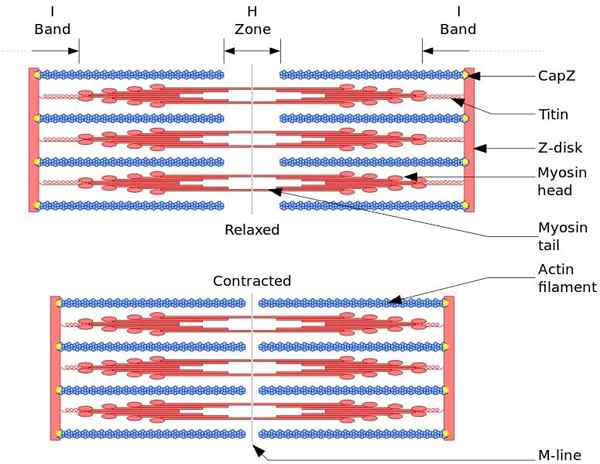
Funkcjonalną i strukturalną jednostką mięśnia szkieletowego to mięso. Podczas skurczu mięśni długość sarcomera osiąga 30% jego pierwotnej długości.
Sorcomeres składają się z grubej, miozyny i cienkich włókien aktyny, które są złożone w złożony sposób. Ogólnie rzecz biorąc, głowy miozyny znajdują się na dystalnych końcach filamentu i jego ogonów w kierunku środka sarkomeru, a organizacja jest dwubiegunowa.
Aby skurczyć mięśni, głowy miozyny, z przeciwnych końców, muszą przejść do dysku Z lub końca (+) filamentu. Ponieważ organizacja grubych włókien jest dwubiegunowa, występuje przesuwanie cienkich włókien na grubych włókienach, napędzane przez ATP.
Siła przemieszczenia występuje, ponieważ setki głowic miozyny, grubego filamentu, oddziałują z cienkim włóknem.
Cytocinezis
Podczas mitozy, gdy mikrotubule bieguna wrzeciona są oddzielone, aktyna i miozyna II tworzą pierścień skurczowy w komórce komórki. Ten pierścień kurczy swoją średnicę i dzieląc komórkę na dwie części.
Przyznanie sztywności błon korowych
W zmutowanych komórkach, które nie mają miozyny II, błona plazmatyczna łatwo się deformuje, gdy nakładana jest siła zewnętrzna. Dzieje się tak, ponieważ miozyna II zapewnia siłę agregacji białkom błony plazmatycznej.
Może ci służyć: adaptacja morfologicznaPrzyczepność komórkowa
W tkance nabłonkowej skurczowe wiązki aktyny i miozyny II znajdują się w dzielnicach błony plazmatycznej i tworzą okrągły pasek otaczający powierzchnię komórkowej komórki. Ten okrągły pas określa kształt komórki i utrzymuje związek między komórkami.
Kontakt między komórkami występuje przez okrągły zjednoczenie pasa do cząsteczek adhezji komórkowej, przy użyciu białek wiążących.
Przemieszczenie niektórych pęcherzyków
Dowody eksperymentalne ujawniają, że miozyna V wykonuje transport błony z aparatu Golgiego do peryferii komórki. Niektóre dowody to:
- W komórkach tkanek nerwowych, przez immunofluorescencję astrocytów stwierdzono, że miozyna V znajduje się obok Golgiego.
- W drożdżach mutacje w genie miozyny V przerywają wydzielanie białka, a zatem białka gromadzą się w cytosolu.
- Izoform miozyny I są odpowiedzialne za transport wakuoli do błony komórkowej. Używając określonych przeciwciał przeciwko izoformom miozyny I, stwierdzono, że izoform te znajdują się w różnych częściach komórki.
Na przykład, gdy żywa ameba jest oznaczona przeciwciałem przeciwko miozynę, transport wakuoli do membrany jest aresztowany. Z tego powodu wakuola rozszerza się, a komórka eksploduje.
Choroby związane z miozyną
Miozyny i utrata ucha
Istnieje wiele genów i mutacji, które powodują utratę ucha. Ta choroba jest często monogenetyczna .
Mutacje w niekonwencjonalnych miozynach, z jedną lub dwiema głowami miozyny, wpływają na funkcjonowanie ucha wewnętrznego. Niektóre z zmutowanych isaform miozyny to miozyna IIIA, miozyna VIIA i miozyna XVA. Niedawno w miozynach odkryto dwie mutacje.
Mutacje w miozynie VI to C.897G> T i P.926Q. Pierwsza mutacja wpływa na region, który oddziałuje z aktywnym zlokalizowanym, zwanym przełącznikiem I. Homozygotyczne do wczesnej mutacji wykazują fenotyp, powodując ciężkie skutki.
Druga mutacja wpływa na obszar obciążenia z obciążeniem, w śmigła alfa w ogonie miozyny VI. Ten region jest ważny dla proksymalnej dimeryzacji silnika i wpływa na funkcję stereo-mistrza miozyny VI.
Może ci służyć: Nauk o biologii pomocniczejKolejną mutacją jest P.ASN207SER, który wytwarza silnik niezdolny do wytwarzania siły. Wynika to z faktu, że Asn 207 jest resztą aminokwasową w miejscu aktywnego, którego funkcją jest związek i hydroliza ATP.
Mutacja p.Arg657TRP powoduje utratę funkcji miozyny VI. Pozostałość ARG bierze udział w zmianach konformacyjnych, które przywiązują hydrolizę do ruchu miozyny.
Miozyna X i rak
Myozina X (myo10) to niekonwencjonalna miozyna wyrażana w mózgu, śródbłonkach i wielu nabłonkach. MyO10 i trzy rodzaje projektów opartych na aktynie (filozody, faktury i projekcje podobne do Filopodianów) działają podczas przerzutów do raka.
Inwazyjne komórki rakowe mają dużą liczbę filozod i wyrażają wysoki poziom fascyny. Białko to wykonuje przecinanie włókien aktyny. Aby uciec od guza pierwotnego, powstają najeźdźce, bogate w aktywność proteolityczną, która trawią otaczającą matrycę pozakomórkową.
Gdy komórki osiągną matrycę pozakomórkową, projekcje podobne do filozod pomagają rozproszyć i kolonizować. Wysoki poziom MyO10 wskazuje na wysoką agresywność i przerzuty w raku piersi.
Wyciszenie Myoxa powoduje utratę przerzutów komórek, które nie są w stanie utworzyć projekcji opartych na aktynie. Wszystkie te prognozy mają rozumiały zrosty, które są transportowane przez My1010 w filozod.
Myox jest zaangażowany w tworzenie centrów. Brak mioxa sprzyja tworzeniu się kolc wielobiegunowych. Myox jest również zaangażowany w sygnalizację w komórkach rakowych. Na przykład myox jest aktywowany przez 3,4,5,-inozytol trifosforan (PIP3).
Bibliografia
- Alberts, ur., Johnson, a., Lewis, J., i kapusta. 2007. Biologia komórki molekularnej. Garland Science, Nowy Jork.
- Brownstein, Z., Abu-Rayyan, a., Karfunkel-Don, zm., Sirigu, s., Davido, ur., Shohat, m., Frydman, m., Houdusse, a., Kanaan, m., Avraham, k. 2014. Nowatorskie mutacje miozyny dla dziedzicznego ubytku słuchu zaburzonego przez ukierunkowane przechwytywanie genomowe i masowo równoległe sekwencjonowanie. European Journal of Human Genetics, 22: 768 -775.
- Courson, zm.S. i Cheney, r.I. 2015. Miozyna-X i choroba. Eksperymentalne badania komórek, 334: 10-15.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, s. 1., Baltimore, zm., Darnell, J. 2003. Biologia komórkowa i molekularna. Redakcja Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madryt, Meksyk, Sāo Paulo.
- Schliwa, m. i Woehlke, G. 2003. Silniki molekularne. Nature, 422: 759 - 765.
- Do warty.D. 2003. Molekularne narzędzia do transportu nietosiolennego. Komórka, 112: 467-480.
- « Charakterystyka egzonukleazy, struktura i funkcje
- Historia bromo, struktura, konfiguracja elektroniczna, właściwości, »

