Struktura Berkelio (BK), właściwości, uzyskiwanie, zastosowania

- 3075
- 112
- Eugenia Czapla
On Berkelium Jest to element chemiczny, którego symbol jest BK. Należy do klasy aktyńczyków, będąc ósmym członkiem. Twój numer atomowy wynosi 97. Jest to syntetyczna metaliczna substancja stała. Ten element nie znajduje się naturalnie nad skorupą Ziemi. Jest obecny w małych ilościach w wydanych paliwach nuklearnych i ma srebrny połysk.
W środowisku rozproszone są również niewielkie ilości z powodu testów broni jądrowej, ze względu.
 Symbol, liczba i masa atomowa elementu Berkelio. Źródło: ME/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.5). Źródło: Wikimedia Commons.
Symbol, liczba i masa atomowa elementu Berkelio. Źródło: ME/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.5). Źródło: Wikimedia Commons. Nie znaleziono praktycznej użyteczności dla Berkelio, ponieważ występuje w bardzo małych ilościach i fakcie, że wszystkie jego izotopy (atomy BK z różną liczbą neutronów w jądrze) są radioaktywne. Jego główne zastosowanie dotyczyło badań naukowych.
Chociaż ich izotopy są sztucznie produkowane w specjalnych laboratoriach i są obsługiwane przez personel ekspertów, odszkodowanie, które emitowane jest przez niebezpieczne promieniowanie.
[TOC]
Nomenklatura
- Berkelio, symbol BK.
- Berkelio-243, BK-243 lub 243BK: Izotop Berkelio z masą atomową 243.
Odkrycie
 1,7 Mikrofotografia Mikrogramy stałego metalicznego Berkelio uzyskane w 1969 roku. Oak Ridge National Laboratory, Departament Energii / domeny publicznej USA. Źródło: Wikimedia Commons.
1,7 Mikrofotografia Mikrogramy stałego metalicznego Berkelio uzyskane w 1969 roku. Oak Ridge National Laboratory, Departament Energii / domeny publicznej USA. Źródło: Wikimedia Commons. Po raz pierwszy został wyprodukowany w 1949 roku przez naukowców Glen Seorg, Stanley G. Thompson i Al Ghiorso na Uniwersytecie Berkeley w Kalifornii, kiedy bombardowali Amerykę-241 cząstkami alfa wysokoenergetycznej za pomocą cyklotronu (akcelerator cząstek).
Natychmiast po napromieniowaniu materiał został odpowiednio rozpuszczony i przepuszczany przez kolumnę żywicy jonowej, stosując roztwór cytrynianu amonu jako eluent.
W ten sposób uzyskali izotop elementu numer 97 o 243 masie atomowej, która emituje cząstki alfa i ma pół -life 4,5 godziny.
Nazwa elementu
Początkowo kilku badaczy zaproponowało, aby element przyjął nazwę jednego z jego odkrywców, Glen Seorg, ponieważ miał zasługę zsyntetyzowania 10 elementów w ciągu kilku lat pracy.
Może ci służyć: BeakerJednak oficjalna organizacja Międzynarodowa Związek Chemii Pure and Applied lub IUPAC (akronim dla angielskiego Międzynarodowe Zrzeszenie Chemii Czystej i Stosowanej) postanowił przypisać nazwę „Berkelio” za uzyskanie na University and City of Berkeley (Kalifornia).
 Pojawienie się obszaru University of Berkeley w Kalifornii. Autor: Sarangib. Źródło: Pixabay.
Pojawienie się obszaru University of Berkeley w Kalifornii. Autor: Sarangib. Źródło: Pixabay. Nazwa Berkeley pochodzi od filozofa Angloairlandé, George Barkeley, nazwa, której wymowa zmieniła w Stanach Zjednoczonych, kiedy miasto i uniwersytet zostały założone w 1869 roku.
To był przypadkowo rok, w którym Dmitri Mendeléyev opublikował swój pierwszy okresowy stół i zaczął przewidzieć istnienie nowych elementów, takich jak Berkelio.
Struktura elektroniczna
Jego konfiguracja elektroniczna wynosi:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5F9 7S2,
lub kompaktowe:
[RN] 5F9 7S2.
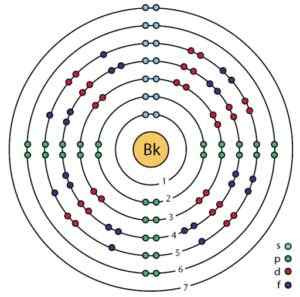 Struktura elektroniczna Berkelio. Można zobaczyć orbitale i elektrony. Hazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Struktura elektroniczna Berkelio. Można zobaczyć orbitale i elektrony. Hazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Uzyskanie
Pierwszą próbkę metalu przygotowano w 1969 r. Przez reakcję redukcji fluoru (BKF3) Z metalem litowym (Li) w temperaturze 1300 K.
Aby przygotować cienkie arkusze metalowe, tlenek BKO jest zmniejszony2 Z Torio (TH) lub metalicznym Lantano.
Fizyczne właściwości Berkelio
Stan fizyczny
Silny metaliczny stał.
Metal Berkelio ma dwie krystaliczne formy: alfa (podwójny sześciokąt) i beta (sześcienne na twarz).
Masa atomowa
247
Temperatura topnienia
1050 ° C (forma alfa)
986 ° C (forma beta)
Punkt wrzenia
2627 ° C
Gęstość
14,78 g/cm3 (forma alfa)
13,25 g/cm3 (forma beta)
Paramagnetyzm
Według niektórych źródeł niektóre związki Berkelio pokazują właściwości paramagnetyczne, co oznacza, że przyciągają je pola magnetyczne.
Ta charakterystyka jest typu paramagnetycznego, ponieważ podczas zawieszenia działania magnetycznego materiał nie utrzymuje samych właściwości.
Właściwości chemiczne
W wysokich temperaturach metaliczny Berkelio jest szybko utleniony w powietrzu lub tlenu, tworząc tlenki. Jest łatwo rozpuszczalny w kwasach mineralnych, uwalniając gaz wodoru H2 i tworzenie jonów BK3+.
Może ci służyć: aluminiowy wodorek (ALH3): struktura, właściwości, użyciaStany utleniania
Wstępne badania tego elementu były ograniczone do eksperymentów wymiany jonów i koprecipitacji, z którymi zaobserwowano, że stan utleniania +3 jest stabilny, a +4 jest dostępny w roztworze wodnym, ponieważ BK3+ Może być utleniany przez jon bromato (bracie4-) Dać BK4+.
Stabilizacja BK4+
W 2017 r. Zgłoszono stabilizację BK4+ W roztworze z użyciem związku utworzonego przez grupy hydroksypirydynonu zjednoczone ze strukturą poliaminową (zwaną ligandem 3,4,3-li (1,2-HOP)).
Ten związek ma osiem miejsc, w których łączy się jon, które odpowiadają atomom tlenu grup C = O i N-OH, pozostawiając BK4+ mocno powiązane z Ligandem, pozostając stabilnym.
Związki stałe
BK4+ może coprecipitate z cerio (CE4+) lub cyrkon (Zr4+) w fosforan lub jodato. Można go również ekstrahować w roztworach heksanowych bis (2-etyloheksyl) wodorofosforan lub inny podobny środek przyjmujący.
Pierwszym związkiem Berkelio, który wystąpił w widzialnych ilościach, był chlorek (BKCL3), z których w 1962 r. Otrzymano 0,000000003. Od tego czasu kilka związków Berkelio było w stanie przygotować i studiować.
Można je wspomnieć na przykład fosforan (BKPO4), oksychlorek (BKOCL), fluorki (BKF3 i BKF4), Dwutlenek (BKO2)2ALBO3), Yodatos (BK (IO3)3 i Bk (IO3)4), Chlorohydrat [BKCL2(H2ALBO)6] Cl, szczawian, związki organetaliczne i związki koordynacyjne, między innymi.
Nowy stan utleniania +5
W 2018 r. Grupa śledczych z kilku krajów udało się wyprodukować kompleks azotanowy z Pentavalent Berkelio (BK5+), którego formuła jest BKO2(NIE3)2-, eliminując dwie bez cząsteczek2 jonu bk (nie3)4-, (Bk3+).
Obliczenia obliczeniowe energii potwierdziły, że stan utleniania +5 jest tym, który ma największą stabilność w tym kompleksie azotanowym Berkenilo, a zatem najbardziej prawdopodobne.
Izotopy
Z Berkelio zsyntetyzowano 14 izotopów z masami atomowymi z 238 do 251. Wszystkie są radioaktywne.
Może ci służyć: Benchilo: hydrogeny benzylowe, karbokacje, rodniki benzyloweNajbardziej stabilnym jest Berkelio-247, którego okres półtrwania wynosi 1380 lat. Każdy atom tego izotopu podczas rozpadu emituje cząstkę alfa i tworzy atom Ameryki-243.
BK-249 ma okres półtrwania wynoszący 330 dni, cierpi na rozkład beta i staje się California-249.
Aplikacje
Ponieważ byli w stanie uzyskać tylko bardzo małe ilości tego elementu, ma on tylko w podstawowych badaniach naukowych.
Przy uzyskaniu cięższych elementów
Izotop BK-249 ma stosunkowo długi okres półtrwania i jest to możliwe.
 Mikrokantyczność BK rozpuszczona w probówce. Do jego uzyskania użyto 250 dni. Można zaobserwować rękawicę ochronną radioaktywności tego elementu. ORNL, Department of Energy / Public Domena. Źródło: Wikimedia Commons.
Mikrokantyczność BK rozpuszczona w probówce. Do jego uzyskania użyto 250 dni. Można zaobserwować rękawicę ochronną radioaktywności tego elementu. ORNL, Department of Energy / Public Domena. Źródło: Wikimedia Commons. W badaniach fizykochemicznych
Badania przeprowadzone z BK umożliwiają dokładniejsze ekstrapolacje dotyczące właściwości i zachowania innych elementów, które następują w serii aktorskiej, ponieważ najcięższe elementy są trudniejsze do uzyskania, mają bardzo krótkie przeciętne życie i są znacznie bardziej radioaktywne.
Ryzyko
Berkelio to element radioaktywny. Uwalnianie radioaktywności w środowisku może dotrzeć do wszystkich gatunków zwierząt i roślin, powodujących ich uszkodzenie. Pogorszenie może gromadzić się w kolejnych pokoleniach.
 Energia energii jądrowej są radioaktywne, a zatem bardzo niebezpieczne. Autor: AR130405. Źródło: Pixabay.
Energia energii jądrowej są radioaktywne, a zatem bardzo niebezpieczne. Autor: AR130405. Źródło: Pixabay. Bibliografia
- LUB.S. National Library of Medicine. (2019). Berkelium - Bk (element). Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- White, f.D. i in. (2019). Współczesna chemia Berkelium i Kalifornii. Chemia 2019 6 sierpnia; 25 (44): 10251-10261. Odzyskane z PubMed.NCBI.NLM.Nih.Gov.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Kelley, m.P. i in. (2018). Kowaleca wiązania i stan utleniania aktyndu INS złożony z terapeutycznym środkiem chelatingowym 3,4,3-L (1,2-HOPO). Inorg. Chem. 2018 7 maja; 57 (9): 5352-5363. Odzyskane z PubMed.NCBI.NLM.Nih.Gov.
- Kovács, a. i in. (2018). Pentalalent Curium, Berkelium i Californium w kompleksie azotanowym: przedłużenie stany chemii i utleniania aktynidów. Chem. 6 sierpnia 2018; 57 (15): 9453-9467. Odzyskane z PubMed.NCBI.NLM.Nih.Gov.
- Orlova, a.Siema. (2007). Chemia i chemia strukturalna bezwodnych ortofosfrów aktyndowych. W chemii strukturalnej nieorganicznych związków aktynidowych. Odzyskane z naukowym.com.
- Choppin, g. i in. (2013). Elementy aktynowe i transaktynowe. W radiochemii i chemii nuklearnej (wydanie czwarte). Odzyskane z naukowym.com.
- Peterson, J.R. i Hobart, D.I. (1984). Chemia Berkelium. Advances Inorganic Chemistry, tom 28, 1984, strony 29-72. Odzyskane z naukowym.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC odzyskał.org.
- « Historia muzyki z prehistorii
- Charakterystyka planowania dydaktycznego, elementy, typy, przykład »

