Charakterystyka asparaginy, struktura, funkcje, biosynteza
- 2426
- 576
- Prokul Woliński
Szparagina (Asn lub n) jest ważnym aminokwasem do sygnalizacji komórkowej i połączenia między białkami a węglowodanami. Jest to jeden z 22 podstawowych aminokwasów i jest katalogowany jako nieistotny, ponieważ jest syntetyzowany przez ciało ssaków.
Ten aminokwas jest klasyfikowany w grupie aminokwasów polarnych bez obciążenia i był pierwszym nagim aminokwasem, co wystąpiło w 1806 r., Gdzie izolowano od soku szparagów (rodzaj rośliny zielnej) przez francuskie chemikalia Vauquelin i Robiquet.
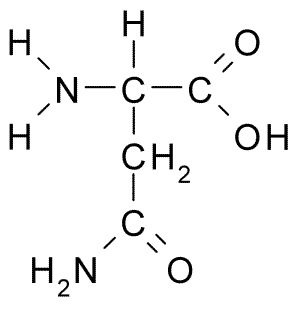
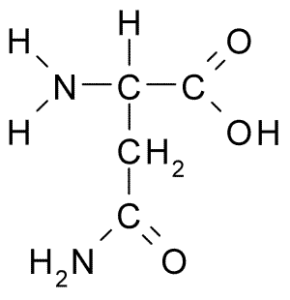 Struktura chemiczna aminokwasowego asparaginy (źródło: Borb, przez Wikimedia Commons)
Struktura chemiczna aminokwasowego asparaginy (źródło: Borb, przez Wikimedia Commons) Pomimo wczesnego odkrycia, biologiczna i odżywcza rola asparaginy nie została rozpoznana, ale ponad 100 lat później, kiedy w 1932 r. Potwierdzono jego obecność w strukturze białka obecnego w nasionach konopnych.
Asparagina i glutamina służą jako substraty dla grup dwóch bardzo częstych aminokwasów w białkach: asparagiczny (kwas asparaginowy) i glutaminian (kwas glutaminowy), odpowiednio. Asparagina i glutamina są łatwo hydrolizowane w tych aminokwasach przez działanie enzymatyczne lub kwasowe i podstawowe związki.
Wiele enzymów serynowych proteazy, które są odpowiedzialne za hydrolizowanie wiązań peptydowych ma asparaginę w łańcuchu bocznym w miejscu aktywnym. Ta pozostałość ma ujemne częściowe obciążenie i jest odpowiedzialna za połączenie w sposób komplementarny z dodatnim obciążeniem białych peptydów, zbliżając się do miejsca cięcia.
Enzym odpowiedzialny za syntezę oksalacetanu z asparaginy jest stosowana w terapii chemioterapeutycznej i jest znany jako L-asparaginaza, która jest odpowiedzialna za katalizowanie fragmentacji hydrolitycznej amidy asparaginy na aspartinian i amonizm.
Asparaginaza jest nadekspresja i oczyszczana z Escherichia coli, Wstrzyknięcie u pacjentów dzieci, którzy mają ostrą białaczkę limfoblastyczną, ponieważ zarówno normalne, jak i złośliwe limfocyty zależą od wychwytywania asparaginy we krwi pod względem wzrostu i mnożenia.
[TOC]
Charakterystyka i struktura
Wszystkie struktury chemiczne aminokwasów mają grupę karboksylową (-COH), grupę aminową (-NH3+), wodór (-H) i grupę R lub zastępczą, które są zjednoczone przez ten sam centralny atom węgla, znany jako węglowy α.
Aminokwasy różnią się od siebie tożsamością ich łańcuchów bocznych, które są znane jako grupy R i które mogą różnić się wielkością, strukturą, grupami funkcjonalnymi, a nawet ładunkiem elektrycznym.
Atomy węgla grup R identyfikują się z literami z greckiego alfabetu. Zatem w przypadku asparaginy węgły łańcucha R są identyfikowane jako węgle β i γ.
Może ci służyć: agar XLD: fundament, przygotowanie i zastosowaniaZgodnie z innym rodzajem nomenklatury atom węgla w grupie karboksylowej (-COH) jest wymieniony jako C-1, więc kontynuując numerowanie, węgiel α wynosiłby C-2 i tak dalej.
Cząsteczka asparaginy ma cztery atomy węgla, w tym węgiel α, węgiel karboksylowy i dwa atomy węgla, które są częścią grupy R, znaną jako karboksamid (-ch2-CO-NH2).
Ta grupa karboksamidowa znajduje się tylko w dwóch aminokwasach: w szparaginie i glutaminie. Ma charakterystykę, że może z łatwością tworzyć mosty wodorowe przez grupę aminową (-NH2) i grupy karbonylowej (-CO).
Klasyfikacja
Asparagina należy do grupy aminokwasów polarnych bez obciążenia, które są bardzo rozpuszczalne aminokwasy w wodzie i bardzo hydrofilowe (ze względu na ich zdolność tworzenia wielu mostów wodoru).
W grupie aminokwasów polarnych bez obciążenia są również seryna, treonina, cysteina i glutamina. Wszystkie są związkami "Zwitterionics”, Ponieważ mają grupę polarną w łańcuchu R, która przyczynia się do neutralizacji obciążeń.
Wszystkie polarne aminokwasy bez obciążenia nie są jonizowalne w pH blisko 7 (neutralne), to znaczy nie mają ładunków dodatnich ani ujemnych. Jednak w kwaśnych i podstawowych pożywkach podstawniki są jonizowane i nabierają obciążenia.
Stereochemia
Centralny węgiel lub węgiel α aminokwasów jest węglem chiralnym, a następnie ma cztery różne zjednoczone podstawniki, co powoduje co najmniej dwa wyróżniające się stereoizomery dla każdego aminokwasowego.
Stereoizomery to obrazy spekulowe cząsteczki, które mają ten sam wzór molekularny, ale nie można ze sobą superponować, takimi jak ręce (lewy i prawy). Są one oznaczone literą D lub L, ponieważ eksperymentalnie roztwory tych aminokwasów obracają spolaryzowaną płaszczyznę światła w przeciwnych kierunkach.
Ogólna asymetria aminokwasów sprawia, że stereochemia tych związków ma ogromne znaczenie, ponieważ każda z nich ma inne właściwości, jest syntetyzowana i uczestniczy w różnych trasach metabolicznych.
Asparagina można znaleźć w formie D-asparagina lub L-asparagina, przy czym ta ostatnia jest najczęstsza w naturze. Jest syntetyzowany przez syntezazę L i metabolizowany dla L-asparaginazy, oba enzymy są bardzo obfite w wątrobie kręgowców.
Funkcje
Łatwość tworzenia mostów wodoru asparaginy sprawia, że jest to kluczowe aminokwas dla stabilności strukturalnej białek, ponieważ może tworzyć wewnętrzne mosty wodorowe z łańcuchami bocznymi innych aminokwasów, które je tworzą.
Może ci służyć: 25 przykładów reprodukcji bezpłciowejAsparagina występuje zwykle na powierzchni typowych środków wodnych, stabilizując ich strukturę.
Wiele glikoprotein może wiązać się z węglowodanami lub węglowodanami poprzez reszty asparaginy, treoniny lub seryny. W przypadku asparaginy galaktozamina acetyl.
Należy podkreślić, że we wszystkich n-glikozylowanych glikoproteinach węglowodany wiążą się z nimi poprzez resztę asparaginy, która znajduje się w określonym regionie oznaczonym jako ASN-X-SER/Thr, gdzie x jest dowolnym aminokwasowym.
Te glikoproteiny są składane w retikulum endoplazmatycznym, gdzie są glikozylowane podczas tłumaczenia.
Biosynteza
Wszystkie organizmy eukariotyczne asymilują amoniak i przekształcają go w glutaminian, glutaminę, karbamil-fosforan i asparagina. Asparagina może być syntetyzowana z glikolitycznych pośredników, w cyklu kwasu cytrynowego (z szczawiki) lub z prekursorów spożywanych w diecie.
Enzym asparaginy syntetaza jest amidotransferazą zależną od glutaminy i ATP, że ATP i nieorganiczny pirofosforan (PPI) pluje i wykorzystuje amoniak lub glutaminę do katalizowania reakcji amidowania i przekształcania asparaginy w asparagine.
Zarówno bakterie, jak i zwierzęta mają asparaginę syntetazy, jednak u bakterii enzym wykorzystuje jon amonowy jako dawcę azotu, podczas gdy u ssaków syntezy syntetyczne wykorzystuje glutaminę jako główny dawca grupy azotowej grupy azotowej.
Zerwanie enzymatyczne ATP do AMP i nieorganicznego pirofosforanu (PPI), wraz z glutaminą jako dawcą grupy Amida, są głównymi różnicami w odniesieniu do biosyntezy l-glutaminy między różnymi organizmami.
Degradacja
W większości badań na temat metabolizmu asparaginy przeprowadzono w roślinach, z uwagi na fakt, że początkowe badania u ssaków utrudniały brak metodologii wystarczająco wrażliwych na testy aminokwasowe na poziomie bardziej złożonych systemów.
L-asparagina jest stale hydrolizowana u ssaków przez L-asparaginazę, aby powodować kwas asparaginowy i amon. Służy do syntezy glikoprotein i jest jednym z głównych prekursorów szczawiki dla cyklu kwasu cytrynowego.
Enzym asparaginazy katalizuje hydrolizę asparaginę do asparaginianu, następnie asparagan jest transaminowany α-cetoglutaranem w celu wytwarzania glutaminianu i szczawicy.
Może ci służyć: epiblastAsparagina synteta, znana również jako ligaza asparaginianowo-amoniaca, jest obficie w komórkach mózgowych ssaków.
Gdy w organizmie postrzegane są niskie poziomy tego enzymu, powstaje tak zwana „aminoacidopatie”, ponieważ substraty prekursorowe gromadzą się w cytoplazmie komórek mózgowych.
Pokarmy bogate w szparaginę
Osoby, które mają ostrą białaczkę limfoblastyczną, zwykle mają niedobory w odniesieniu do enzymu asparaginy syntetazy i zależą od asparaginy w krążeniu, dlatego zalecane są dietę w żywności bogatej w asparaginę lub egzogeniczne podaż tego samego.
Wśród wielu potraw o wysokiej zawartości szparaginy jest ona.
Istnieją koncentraty L-asparagina, które są sformułowane dla sportowców o wysokich konkurencjach, ponieważ ich spożycie pomaga zregenerować białka, które tworzą tkanki.
Ponadto osoby, które mają deficyt w syntezie aminokwasów, również spożywają te tabletki, aby uniknąć zaburzeń w ich ośrodkowym układzie nerwowym.
Asparagina jest łatwiejsza do metabolizowania poprzez swoją postać L-asparaginę, ponieważ wiele enzymów zaangażowanych w ich metabolizm nie rozpoznaje formy D-asparagina, a zatem nie wszystkie platoski spożywane w żywności są dostępne dla różnych procesów organizmu.
Obfite spożycie szparaginy może być korzystne, jednak nie jest zalecane.
Bibliografia
- Cooney, zm. DO., Capizzi, r. L., & Handchumacher, r. I. (1970). Ocena metabolizmu L-asparagina u animów i człowieka. Badania nad rakiem, 30 (4), 929-935
- Dunlop, s. 1. C., Roon, r. J., A nawet H. L. (1976). Stosowanie d-asparaginy przez Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, F. (2017). Postęp w metabolizmie szparaginy. W Postęp w botanice Tom. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Montaż oligosacharydów powiązanych ze szparaginą. Coroczny przegląd biochemii, 54 (1), 631-664
- Mathews, c. K., & Ahern, K. G. (2002). Biochemia. Edukacja Pearsona.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-asparagina. Akt krystalograficzny Sekcja E: Struktura raportów online, 63 (9), 3802-3803.
- « Charakterystyka kwasu glutaminowego, funkcje, biosynteza
- Charakterystyka rąk, struktura, funkcje »

