Funkcje obsługi, funkcje i przykłady
- 4789
- 790
- Bertrand Zawadzki
wsparcie Są to nieaktywne formy enzymów, to znaczy są enzymami, których brakuje ich kofaktorów lub koenzymów, które są niezbędne do wykonywania reakcji katalitycznych, których są odpowiedzialni.
Enzymy są białkami o aktywności katalitycznej. Jego funkcja w zasadzie przyspiesza przebieg różnych rodzajów reakcji chemicznych w komórkach, co jest bardzo ważne dla istnienia wszystkich żywych istot na Ziemi.
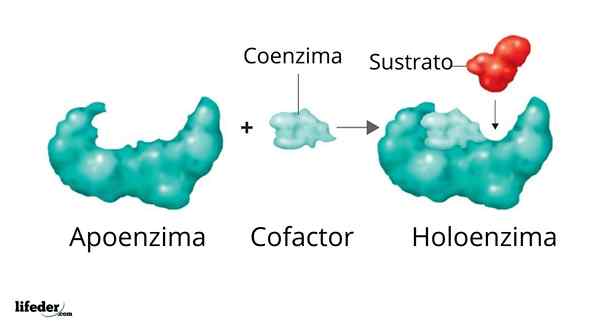
 Holoenzym jest tworzony przez kibica i jego kofaktor/koenzym/grupa protetyczna
Holoenzym jest tworzony przez kibica i jego kofaktor/koenzym/grupa protetyczna Aktywność wielu enzymów zależy od tożsamości i uporządkowania aminokwasów, które je zawierają, to znaczy na własnych strukturach białkowych i od integralności tych struktur w warunkach rodzinny.
Chociaż dotyczy to wielu enzymów, są takie, które wymagają dodatkowych elementów nie -białkowych do wykonywania swoich funkcji. Takie elementy są znane jako Kofaktory, Jeśli są to jony nieorganiczne, lub koenzymy, Jeśli są to cząsteczki złożone lub organiczne.
Zasadniczo zarówno kofakory, jak i koenzymy są związane ze względną stabilnością do struktury białkowej enzymów, których aktywność katalityczna promuje; Gdy to powiązanie jest trwałe (kowalencyjne), grupy te są wówczas znane jako Grupy protetyczne.
Przykłady wsparcia
 Ilustracja 3D polimerazy DNA
Ilustracja 3D polimerazy DNA Aktywny zestaw enzymatyczny utworzony przez białko o aktywności katalitycznej i jego kofaktor/koenzym/grupa protetyczna nazywana jest Holoenzyme albo sprzężony enzym. W holoenzymie część białka odpowiada tak zwanej wspierający lub apoproteina, w której brakuje aktywności.
Przykłady niektórych ważnych wsparcia to:
- Enzym Polimeraza DNA, Odpowiedzialny za replikację DNA komórkową, bez zbieżnego jonu magnezu, który służy jako kofaktor.
- Enzym Anhydraza węglowa, odpowiedzialny za katalizowanie konwersji CO₂ i H₂0 do jonów wodorowęglanu i H+, bez benodalnego jonu cynku, który służy jako kofaktor.
- Enzym hemoglobina, odpowiedzialny za transport tlenu wewnątrz czerwonych krwinek (erytrocyty) przez krew zwierząt ssaków, bez ich hemo grupy protetycznej.
- Enzym Dehydrogenaza mleczanowa, odpowiedzialny za produkcję mleczanu z pirogronianu, bez NADH, który służy jako kofaktor.
Charakterystyka apoenzymów
Wsparcie to nieaktywne enzymy, których potrzebują, aby osiągnąć swoją aktywację, połączenie kofaktora lub koenzymu, ale nie są zjednoczone z jednym.
Biorąc to pod uwagę, można powiedzieć, że takie cząsteczki mają pewne cechy, a mianowicie:
Są białkami
W przeciwieństwie do kofaktorów i koenzymów, które są elementami nie -białkami niezbędnymi do funkcji holoenzymów, wsparcie to białka.
Poprzednie stwierdzenie jest zatem rozumiane, że podpory są tworzone przez łańcuchy specjalnych cząsteczek zwanych aminokwasami, które są połączone przez rodzaj łącza znanego jako wiązanie peptydowe.
Sekwencja aminokwasowa każdego wsparcia jest genetycznie określona, a to z kolei warunki przestrzennego lub trójwymiarowego porządku, ściśle związane ze swoistością substratów, związkiem z kofaktorami/koenzymami/grupami protetycznymi, ustanowienie miejsca aktywnego, itp.
Jako białka, apoenzymy mają również: ładunek elektryczny, określony przez zawartość aminokwasów i pH pożywki, w której je znajdują; Wymagania dotyczące temperatury, pH i siły jonowej charakterystyczne, w których może on, w obecności kofaktorów, działać z ich optymalną prędkością; inhibitory i konkurenci itp.
Mogą dołączyć do substratów
Chociaż sami nie są w stanie katalizować reakcji enzymatycznej, wiele wsparcia zachowuje zdolność do łączenia substratów, które uczestniczą w reakcji, która je charakteryzuje; Z tego powodu są one zwykle używane w niektórych kontekstach eksperymentalnych.
Mogą dołączyć do kofaktorów, koenzymów lub grup protetycznych
W większości przypadków wsparcie można uznać za nieaktywne enzymy przygotowany Dołączyć do tych cząsteczek, które uczestniczą w ich funkcjach, to znaczy: do ich kofaktorów, koenzymów lub grup protetycznych.
Może ci służyć: flora i fauna wybrzeża EkwadoruKofakory mogą uczestniczyć bezpośrednio w reakcjach katalitycznych lub po prostu przyczyniać się do stabilizacji ogólnej struktury holoenzymu.
Wśród głównych kofaktorów, którzy uczestniczą w holoenzymach komórkowych, są:
- Żelazo (Fe2+)
- Miedź (Cu2+)
- Wapń (CA2+)
- Cynk (Zn2+)
- Magnez (MG2)
- Mangan (Mn2+)
- Kobalt (co)
- Nickel (NI)
Wśród głównych koenzymów można wyznaczyć:
- Witaminy: B9, B3, C
- Triffosforan adenosín (ATP)
- Flavín adenín dinukleotyd (moda)
- Nikotynamid lub niciotín dinukleotyd dycleotide (NAD)
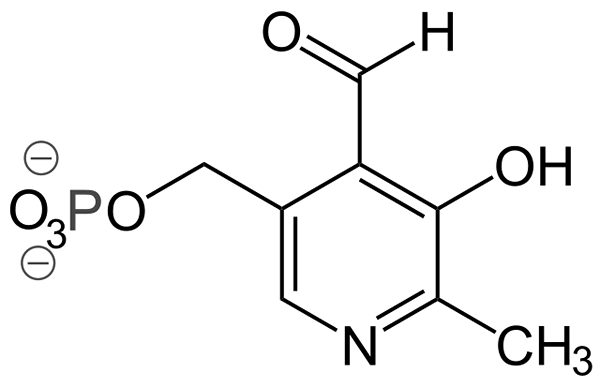 Struktura piridoksal-fosforan (źródło: AYACOP, domena publiczna, przez Wikimedia Commons)
Struktura piridoksal-fosforan (źródło: AYACOP, domena publiczna, przez Wikimedia Commons) Niektóre ważne grupy protetyczne to:
- Grupa hemo
- Biotyna
- Pirofosforan tiaminy
- Pirydoksal-fosforan
Funkcje podenzimów
Ponieważ podpory są częściami białkowymi holoenzymów, uczciwe jest uznać je za najważniejszą część. Nawet w obecności odpowiednich koenzymów, koenzymów i substratów, bez podtrzymywania, żadna z reakcji enzymatycznych katalizowanych przez te enzymy.
W tym sensie główną funkcją wsparcia jest wniesienie zarówno głównej struktury holoenzymu, do której należy, jako miejsce Unii dla kofaktora, koenzymu i/lub grupy protetycznej, jak i substratów uczestniczących w reakcji reakcji.
Z strukturalnego punktu widzenia holoenzym bez jego apoenzymu jest niczym więcej niż kofaktorem, a sam kofaktor jest niczym więcej niż stosunkowo obojętną cząsteczką (biologicznie), tak że wsparcie jest odpowiedzialne w rzeczywistości, aby przeprowadzić. reakcja katalityczna, wspomniana przez wymienione elementy nie -białko.
Może ci służyć: actynomycetesZatem funkcje wsparcia, chociaż są to nieaktywne enzymy, zależą od:
- Jego liniowy łańcuch aminokwasów lub struktury pierwotnej (jeśli są enzymatycznymi kompleksami utworzonymi przez więcej niż jedną podjednostkę, wówczas omówiono go o „ich łańcuchach liniowych”).
- Sposób, w jaki te łańcuchy są uporządkowane w przestrzeni, to znaczy struktury wtórne, trzeciorzędowe i czwartorzędowe, gdy sprawa.
- Właściwa konformacja miejsc, które są fundamentalne dla katalizy, to znaczy miejsce katalityczne z aminokwasami, które uczestniczą w reakcji, miejsce Unii dla koenzymów lub grup protetycznych; itp.
- Stabilność struktury w warunkach komórkowych lub rodzinny, fakt, że jest to bezpośrednio związane z zdolnością apoenzymu do tworzenia holoenzymu i innych.
Bibliografia
- Boyer, str. D., I Krebs i. G. (1986). Enzymy. Academic Press.
- Garrett, r. H., I Grisham, C. M. (2001). Zasady biochemii: z ludzkim skupieniem. Brooks/Cole Publishing Company.
- Gruber, k., Puffer, ur., & Kräutler, b. (2011). Witamina B 12-pochodne-enzym kofaktorów i ligandy białek i kwasów nukleinowych. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, r. K., Granner, zm. K., Mayes, str. DO., & Rodwell, V. W. (2014). Ilustrowana biochemia Harpera. McGraw-Hill.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Staiano, m., Pennacchio, a., Varriale, a., Capo, a., Majoli, a., Capacchione, c., & D'auria, s. (2017). Enzymy jako czujniki. W metodach enzymologii (vol. 589, s. 115-131). Academic Press.
- « Składający petycję do tego, jakie jest zastosowanie, przykład, format (model)
- Oddychanie rozgałęzione, jak to się robi i przykłady »

