Bezwodne kwasowe Jak powstają, zastosowania i przykłady

- 3942
- 655
- Matylda Duda
bezwodniki kwasowe Są one uważane za ogromne znaczenie wśród szerokiej gamy istniejących związków organicznych. Są one przedstawione jako cząsteczki, które mają dwie grupy kwasowe (podstawniki organiczne, których wzór jest RCO, gdzie R jest łańcuchem węglowym) zjednoczonym z tym samym atomem tlenu.
Istnieje również klasa bezwodników kwasowych, które są powszechnie znajdujące. Aby nazwać te typu, którego struktura jest symetryczna, należy dokonać tylko wymiany terminów.

Ekspresję kwasu należy zastąpić w nomenklaturze oryginalnego kwasu karboksylowego terminem bezwodnika, co oznacza „bez wody”, bez zmiany reszty nazwy uformowanej cząsteczki. Związki te można również generować na podstawie jednej lub dwóch grup kwasowych z innych kwasów organicznych, takich jak kwas fosfoniczny lub kwas sulfonowy.
Podobnie bezwodne kwasowe mogą być spowodowane na podstawie kwasu nieorganicznego, takiego jak kwas fosforowy. Jednak jego właściwości fizyczne i chemiczne, jego zastosowania i inne cechy zależą od przeprowadzonej syntezy i struktury bezwodnika.
[TOC]
Jak powstają kwaśne bezwodne?
Niektóre bezwodne kwasowe pochodzą z różnych sposobów, w laboratorium lub w branży. W syntezie przemysłowej bezwodnik octowy jest przyjmowany jako przykład, który jest wytwarzany głównie w procesie karbonilacji cząsteczki octanu metylu.
Innym przykładem tej syntezy jest synteza bezwodnika maleico, która jest wytwarzana przez utlenianie cząsteczki benzenowej lub butanu.
Może ci służyć: wodorotlenek cynku (Zn (OH) 2)Jednak w syntezie kwasowych anihydidów w laboratorium nacisk kładzie się na odwodnienie odpowiednich kwasów, takich jak wytwarzanie bezwodnika etyanicznego, w którym dwie cząsteczki kwasu etycznego są odwodniane, aby dało wspomniany związek.
Może również wystąpić odwodnienie wewnątrzcząsteczkowe; Oznacza to, że w tej samej cząsteczce kwasu z dwiema grupami karboksylowymi (lub dikarboksylowymi), ale jeśli występuje odwrotnie, a bezwodnik kwasu cierpi hydrolizę, regeneracja kwas.
Bezwodniki kwasowe, których podstawniki acylowe są równe, podczas gdy w bezwodach tego typu uważane za mieszane te cząsteczki są różne.
Jednak gatunki te są również generowane, gdy zachodzi reakcja między kwasem haluur (którego ogólnym wzorem jest (RCOX)) z cząsteczką karboksylanową (której ogólnym wzorem jest r'cooo-))))))))))))))))))))))))))))))))))))))))))))))). [2]
Ogólna formuła
Ogólny wzór bezwodników kwasowych wynosi (RC (O))2Lub, co jest lepiej obserwowane na obrazie umieszczonym na początku tego artykułu.
Na przykład w przypadku bezwodnika octowego (z kwasu octowego) ogólny wzór jest (CH3WSPÓŁ)2Lub pisanie podobnie dla wielu innych podobnych bezwodek kwasowych.
Jak wspomniano powyżej, związki te mają prawie taką samą nazwę ich kwasów prekursorów, a jedyną rzeczą, która się zmienia, jest termin kwas przez bezwodnik, ponieważ należy zastosować te same zasady numerowania atomów i podstawników, aby odnieść sukces w ich nomenklaturze.
Aplikacje
Niezwodniki kwasowe mają wiele funkcji lub zastosowań w zależności od badanego pola, ponieważ mają one wysoką reaktywność, mogą być odczynnikami prekursorowymi lub częścią wielu ważnych reakcji.
Może ci służyć: pirolizaPrzykładem tego jest przemysł, w którym bezwodnik octowy jest wytwarzany w dużych ilościach, ponieważ jest to najprostsza struktura, którą można izolować. Ten bezwodnik jest stosowany jako ważny organiczny odczynnik, taki jak estry octanu.
Użytek przemysłowy
Z drugiej strony, bezwodnik maleico jest pokazany z cykliczną strukturą, stosowaną w produkcji zasięgu do użytku przemysłowego i jako prekursor niektórych żywic poprzez proces kopolimetryzacji z cząsteczkami Stretus. Ponadto substancja ta służy jako dienofil, gdy przeprowadzana jest reakcja Dielsa-Aldera.
Podobnie istnieją związki, które mają dwie cząsteczki bezwodek kwasowych w ich strukturze, takie jak etytylboksyl lub Dianhydid.
Oprócz nich występuje mieszany bezwodnik zwany 3'-fosfoadenosín-5'-fosfosulfate, z kwasów fosforowych i siarkowych, który stanowi najczęstszy koenzym w biologicznych reakcjach przenoszenia siarczanu.
Przykłady bezwodników kwasowych
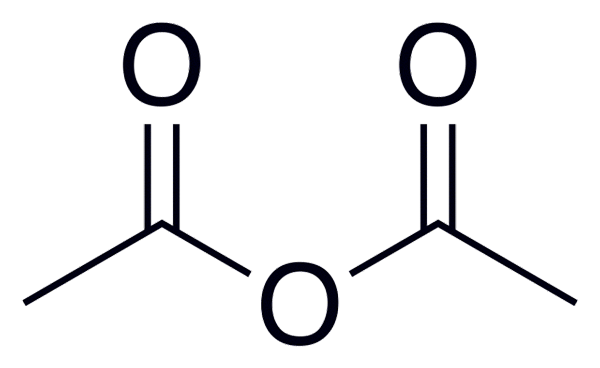 Bezwodnik octowy
Bezwodnik octowy Poniżej znajduje się lista z nazwami niektórych bezwodników kwasowych, aby podać kilka przykładów tych ważnych związków w chemii organicznej, które mogą tworzyć związki o strukturze liniowej lub pierścienie kilku elementów:
- Bezwodnik octowy.
- Bezwodnik propanowy.
- Benzoiczny bezwodnik.
- Bezwodnik maleico.
- Bezwodnik bursztynowy.
- FTALICZNY Bezwodnik.
- Naftalente -trakarboksylowy dianhydrohek.
- Etytertarboksylowy Dianhydrohde.
- Benzoquinonterarboksylowy Dianhydride.
Podobnie jak te bezwodne z tlenem, podawane są inne związki, w których atom siarki może zastąpić tlen zarówno w grupie karbonylowej, jak i środkowym tlenu, na przykład: na przykład:
Może ci służyć: acetanylide (C8H9NO)- Bezwodnik tioacetyczny (wybierz3C (s)2ALBO)
Istnieje nawet dwie cząsteczki kwasu, które tworzą powiązania z tym samym atomem siarki; Związki te są nazywane Tioanhydrydy, mianowicie:
- Octowy tioanhydrolid (CH3WSPÓŁ))2S)
Bibliografia
- Wikipedia. (2017). Wikipedia. Odzyskane z.Wikipedia.org
- Johnson, a. W. (1999). Zaproszenie do chemii organicznej. Odzyskane z książek.Google.współ.Iść.
- Acton, q. DO. (2011). Hydrole bezwodnika kwasu: postęp w badaniach i zastosowaniu. Odzyskane z książek.Google.współ.Iść
- Bruckner, r., I Harmata, m. (2010). Mechanizmy organiczne: reakcje, stereochemia i synteza. Odzyskane z książek.Google.współ.Iść
- Kim, J. H., Gibb, h. J., i Iannucci, do. (2009). Cykliczne bezwodne kwasu: aspekty zdrowia ludzkiego. Odzyskane z książek.Google.współ.Iść

