Rodzaje baterii, cechy i reakcje

- 4269
- 585
- Herbert Wróblewski
Na rynku możesz się różnić Rodzaje baterii z Jej karakterystyka własny. Akumulatory, które są niczym więcej niż ogniwami wolmicznymi, zapewniają konsumentowi przewagę w każdym miejscu (pod warunkiem, że warunki nie są drastyczne).
Zasadniczo akumulatory można kupić odizolowane; Ale są również przyłączeni do siebie w szeregu lub równolegle, których zestaw jest tym, co nazywają bateriami. I tak czasami terminy „baterie” i „baterie” są zwykle używane bezkrytycznie, nawet jeśli nie są takie same.
 Baterie alkaliczne: jeden z najbardziej znanych rodzajów baterii
Baterie alkaliczne: jeden z najbardziej znanych rodzajów baterii Baterie mogą mieć niezliczone kolory, kształty i rozmiary, co można wykonać z innych materiałów. Również, a co ważniejsze, ich wewnętrzna struktura, w której opracowywane są reakcje chemiczne wytwarzające energię elektryczną, służy ich odróżnieniu od siebie.
Na przykład trzy alkaliczne akumulatory, jedna z najczęstszych jest pokazana na górnym obrazie. Termin alkaliczny odnosi się do faktu, że medium, w którym występuje uwalnianie i przepływ elektronów, jest podstawowe; Oznacza to, że ma pH większy niż 7, a aniony OH dominują- i inne ujemne opłaty.
[TOC]
Klasyfikacja PILAS
Przed rozwiązaniem niektórych różnych rodzajów baterii należy wiedzieć, że są one klasyfikowane na całym świecie jako pierwotne lub wtórne.
- Baterie podstawowe
Baterie pierwotne to te, które po zużyciu należy je odrzucić lub poddać recyklingowi, ponieważ reakcja chemiczna, na której utrzymuje się prąd elektryczny, jest nieodwracalna. Dlatego nie można ich naładować.
Są one głównie stosowane w zastosowaniach, w których niepraktyczne jest naładowanie energii elektrycznej; na przykład na urządzeniach wojskowych, na środku pola bitwy. Są również zaprojektowane do sprzętu, które zużywają niewielką energię, aby trwały dłużej; Na przykład zdalne sterowanie lub konsole przenośne (Gameboy, Tetris i Tamagothi).
Baterie alkaliczne, aby cytować inny przykład, należą również do typu pierwotnego. Zwykle mają formy cylindryczne, chociaż nie oznacza to, że baterie cylindryczne nie mogą być wtórne ani doładowe.
- Baterie wtórne
W przeciwieństwie do baterii podstawowych, wtórne można ładować, gdy zabraknie im energii.
Wynika to z faktu, że reakcje chemiczne, które występują w nich, są odwracalne, a zatem po zastosowaniu określonego napięcia powoduje, że gatunek produktu staje się odczynowy, aby ponownie rozpocząć reakcję.
Niektóre wtórne baterie (zwane bateriami) są zwykle małe, podobnie jak pierwotne; Są one jednak przydzielane na urządzenia, które zużywają więcej energii i dla których stosowanie baterii pierwotnych byłoby ekonomicznie i energetycznie. Na przykład akumulatory telefonów komórkowych zawierają akumulatory wtórne.
Również wtórne akumulatory są przeznaczone do dużego sprzętu lub obwodów; Na przykład akumulatory samochodowe, które składają się z kilku akumulatorów lub ogniw woltowych.
Zazwyczaj są droższe niż baterie podstawowe i akumulatory, ale w długim okresie są one bardziej odpowiednią i skuteczną opcją.
- Inne aspekty
Baterie są klasyfikowane w pierwotnej lub wtórnej; Ale komercyjnie lub popularnie są one zwykle klasyfikowane zgodnie z formą (cylindryczne, prostokątne, przyciski), do przeznaczone urządzenie (kamery, pojazdy, kalkulatory), do ich nazw (AA, AAA, C, D, N, A23 itd. .) Oraz do kodów IEC i ANSI.
Może ci służyć: pirydyna: struktura, właściwości, zastosowania, toksyczność, syntezaRównież cechy, takie jak napięcie (1,2 do 12 woltów), a także ich okres użytkowania i ceny, są odpowiedzialne za przekazanie określonej klasyfikacji w oczach konsumenta.
Lista rodzajów stosów
- Baterie z węgla-zinc
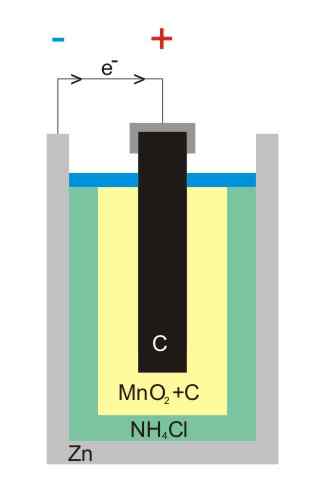 Ilustracja akumulatora cynkowego
Ilustracja akumulatora cynkowego Akumulatory węgla-zinc (znane również jako komórki Leclanché lub Salinas Pilas) są jednym z najbardziej prymitywnych i są obecnie uważane za prawie nieużywane przed innymi akumulatorami; Zwłaszcza przed akumulatorami alkalicznymi, które chociaż są nieco droższe, mają czas na całe życie i główne napięcia.
Jak sama nazwa wskazuje, jej elektrody składają się z puszki cynku i pręta grafitowego, odpowiadającego odpowiednio anodzie i katody.
W pierwszej elektrodzie anoda pochodzi z elektronów przez utlenianie metalicznego cynku. Elektrony te przechodzą następnie obwód zewnętrzny, który zasila urządzenie elektrycznością, a następnie kończą katodę grafitową, w której cykl jest zakończony, gdy dwutlenek manganu jest zmniejszony.
Reakcje
Równania chemiczne dla reakcji występujących w elektrodach to:
Zn (S) → Zn2+(AC) + 2E- (Anoda)
2 Mno2(s) + 2e- + 2 NH4Cl (AC) → Mn2ALBO3(s) + 2 NH3(AC) + H2Lub (l) + 2 Cl- (AC) (katoda)
Baterie te są bardzo podobne do alkalicznego: oba są cylindryczne (takie jak obrazy). Jednak akumulatory Carbon-Zinc można rozróżnić, jeśli cechy oznaczone za granicą są szczegółowo odczytane lub jeśli kod IEC jest poprzedzony literą R. Jego napięcie wynosi 1,5 V.
- Baterie alkaliczne
Akumulatory alkaliczne są bardzo podobne do baterii typu węgla-zinc, z różnicą, w której ośrodek, w którym elektrody zawierają aniony-. To medium składa się z silnych elektrolitów wodorotlenku potasu, KOH, który przyczynia się do OH- które uczestniczą i „współpracują” w migracji elektronów.
Występuje w różnych rozmiarach i napięciach, chociaż najczęstsze to 1,5 V. Są to być może najbardziej znane baterie na rynku (na przykład Duracell)).
Reakcje występujące w ich elektrodach to:
Zn (s) + 2OH-(aq) → ZnO (S) + H2Lub (l) + 2e- (Anoda)
2mn2(s) + h2Lub (l) + 2e- → Mn2ALBO3(s) + 2OH-(aq) (katoda)
Wraz ze wzrostem temperatury reakcje występują szybciej i szybciej akumulatory są rozładowywane. Co ciekawe, popularne pogłoski zostały uruchomione, aby umieścić je w zamrażarce, aby zwiększyć czas życia; Ale podczas chłodzenia jego zawartość może ponieść możliwe zestalania, które przynoszą z nimi dalsze wady lub ryzyko.
Rtęć
 Prawdopodobna bateria rtęciowa, którą można pomylić z baterią tlenku srebrnego. Źródło: Multicherry [CC0].
Prawdopodobna bateria rtęciowa, którą można pomylić z baterią tlenku srebrnego. Źródło: Multicherry [CC0]. Baterie rtęci są bardzo charakterystyczne ze względu na ich szczególny wstyd srebrnych guzików (obraz doskonały). Prawie wszyscy rozpoznają je na pierwszy rzut oka. Są również alkaliczne, ale ich katoda zawiera, oprócz dwutlenku grafitu i manganu, tlenku rtęci, HGO; który po zmniejszeniu staje się metalową rtęcią:
Zn (s) + 2OH-(AC) → ZnO (S) + H2Lub (l) + 2e-
HGO (S) + H2O + 2e- → Hg (s) + 2OH-
Może ci służyć: tlenek magnezu: struktura, właściwości, nomenklatura,Zwróć uwagę, jak w tych reakcjach komórkowych aniony OH są spożywane i regenerowane-.
Będąc małymi akumulatorami, przeznaczony jest do małych artefaktów, takich jak zegarki, kalkulatory, elementy sterujące zabawkami itp. Kto użył któregokolwiek z tych obiektów zauważy, że nie jest konieczne zmiana baterii na prawie „wieczność”; które miałyby około 10 lat.
Tlenek srebra
 Baterie tlenku srebra. Źródło: Lukas A, Cze [domena publiczna].
Baterie tlenku srebra. Źródło: Lukas A, Cze [domena publiczna]. Główną wadą akumulatorów rtęci jest to, że po odrzuceniu stanowią poważny problem dla środowiska, ze względu na toksyczne cechy wspomnianego metalu. Może brakuje to kodów IEC i ANSI brakuje. W przypadku baterii tlenku srebrnego jego kod IEC jest poprzedzony literą.
Jeden z substytutów akumulatorów rtęci odpowiada baterii tlenku srebra, znacznie droższego, ale o mniejszym wpływie ekologicznym (obraz doskonały). Na początku zawierały rtęć w celu ochrony cynku przed korozją alkaliczną.
Jest dostępny z napięciem 1,5 V, a jego zastosowania są bardzo podobne do napięcia Pila Mercury. W rzeczywistości na pierwszy rzut oka obie akumulatory wyglądają identycznie; Chociaż mogą istnieć znacznie większe baterie tlenku srebra.
Reakcje w ich elektrodach to:
Zn (s) + 2OH-(AC) → Zn (OH)2(s) + 2 e-
Ag2Lub (s) + 2h+(AC) + 2E- → 2ag (s) + h2Lub (l)
Następnie woda cierpi elektroliza, rozkładając się na jach H+ I och-.
Zauważ, że zamiast rtęci powstaje w metalowej srebrnej katodzie.
- Nickel-Cadmium Pilas (Nicad)
 Bateria NICD. Źródło: Lordider [CC0].
Bateria NICD. Źródło: Lordider [CC0]. Od tego momentu rozważane są wtórne baterie lub baterie. Podobnie jak rtęć, akumulatory niklu-kadm są szkodliwe dla środowiska (dla fauny i zdrowia) przez metal kadmowy.
Charakteryzują się wytwarzaniem wysokich prądów elektrycznych i wiele razy można naładować. W rzeczywistości 2000 razy można naładować, co jest równe niezwykłej trwałości.
Jego elektrody składają się z wodorotlenku tlenku niklu, dziecka (OH), dla katody i metalicznego kadmu dla anody. W istocie podkład chemiczny pozostaje taki sam: kadm (zamiast cynku) traci elektrony, a kadm nio (OH) wygrywa.
Reakcje półtleśniowe to:
CD (S) + 2OH-(AC) → CD (OH)2(s) + 2e-
2NIO (OH) (S) + 2H2Lub (l) + 2e- → 2ni (OH)2(S) + OH-(AC)
OH Aniony-, Znowu pochodzą z elektrolitu Koh. Akumulatory Nicad w końcu wytwarzają wodorotlenki metali niklu i kadmu.
Są one używane indywidualnie lub sprzężone w pakietach (takich jak żółty, lepszy obraz). Przychodzą wtedy w dużych lub małych paczkach. Dzieci znajdują się w zabawkach; Ale duże, są przeznaczone do samolotów i pojazdów elektrycznych.
- Nickel-Hydro Metallic Pilas (NI-HM)
 Baterie NI-HM. Źródło: Ramsh ng Flickr (https: // www.Flickr.com/Photos/Rameshng/5645036051)
Baterie NI-HM. Źródło: Ramsh ng Flickr (https: // www.Flickr.com/Photos/Rameshng/5645036051) Kolejnym dobrze znanym baterią lub akumulatorem, która przekracza Nicad's w zakresie energii, jest Ni-HM (nikiel i hydrok metalowy). Może być dostępny w formacie cylindrycznym (konwencjonalne baterie, obraz doskonały) lub sprzężony z baterią.
Chemicznie prezentuje prawie takie same cechy, jak akumulatory NICAD, z główną różnicą opartą na elektrodzie ujemnej: katoda nie jest kadmem, ale ze stopu międzymetalicznego ziem rzadkich i metali przejściowych.
Może ci służyć: suszarka do obrotowej: operacja, do czego jest, części, aplikacjeTen stop jest odpowiedzialny za wchłanianie wodoru utworzonego podczas obciążenia, generując złożony wodorek metalu (stąd litera H na jego nazwę).
Podczas gdy akumulatory NI-HM zapewniają więcej energii (około 40% więcej), są droższe, noszą się szybciej i nie można ich ponownie załadować takiej samej liczby razy niż akumulatory NICAD; to znaczy mają niższy okres użytkowania. Brakuje im jednak efektu pamięci (utrata wydajności baterii, nie są całkowicie rozładowane).
Z tego powodu nie powinny być używane w maszynach działających w perspektywie długoterminowej; Chociaż ten problem został wypełniony bateriami LSD-NIHM. Podobnie, akumulatory lub akumulatory NI-HM mają bardzo stabilne charakterystyki termiczne, działając w szerokim zakresie temperatur bez reprezentowania ryzyka.
Reakcje
Reakcje występujące w ich elektrodach to:
Ni (oh)2(S)+ OH-(ac) ⇌ nio (oh) (s) + h2Lub (l) + e-
H2Lub (l) + m (s) + e- ⇌ Och-(AC)+ MH (S)
- Baterie jon-litio
 Bateria litowo-jonowa laptopa. Źródło: Kristoferb of Wikipedia.
Bateria litowo-jonowa laptopa. Źródło: Kristoferb of Wikipedia. W bateriach i bateriach litowych oparte są na migracji jonów Li+, które są przenoszone z anody do katody, iloczyn odpychania elektrostatycznego przez rosnący ładunek dodatni.
Niektóre mogą naładować, takie jak baterie laptopa (obraz doskonały), a inne, cylindryczne i prostokątne (gładkie2, Lisocl2 lub limuzyna2) NIE.
Baterie jon-litio charakteryzują się byciem bardzo światłem i energią, co pozwala na ich stosowanie w wielu urządzeniach elektronicznych, takich jak smartfony i sprzęt medyczny. Nie ledwo cierpią z powodu efektu pamięci, ich gęstość obciążenia przekracza gęstość akumulatorów i akumulatorów Nicad i Ni-HM oraz opóźnia się więcej w pobieraniu.
Są jednak bardzo wrażliwe na wysokie temperatury, nawet eksplodują; A ponadto są one zwykle droższe przed innymi bateriami. Mimo to na rynku baterie litowe są widoczne z dobrymi oczami, a wielu konsumentów kwalifikuje je jako najlepsze.
- Kwasowe baterie ołowiu
 Typowy akumulator samochodowy CARF. Źródło: Tntflash [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Typowy akumulator samochodowy CARF. Źródło: Tntflash [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] I wreszcie, kwasowe bakterie ołowiowe, jak sama nazwa wskazuje, nie zawierają jonów OH- Ale h+; W szczególności stężony roztwór kwasu siarkowego. Komórki woltowe znajdują się wewnątrz pudeł (górny obraz), gdzie trzy lub sześć z nich można połączyć szeregowo, dając akumulator odpowiednio 6 lub 12 V.
Jest w stanie generować duże ilości ładunku elektrycznego, a ponieważ są one bardzo ciężkie, są one przeznaczone do zastosowań lub urządzeń, których nie można transportować ręcznie; Na przykład samochody, panele słoneczne i okręty podwodne. Ta kwasowa bateria jest najstarsza i nadal obowiązuje w branży motoryzacyjnej.
Twoje elektrody są wykonane z ołowiu: PBO2 Dla katody i gąbczastego metalicznego ołowiu dla anody. Reakcje, które w nich występują, to:
PB (S) +HSO-4(aq) → PBSO4(s) +h+(aq) + 2e-
PBO2(s) +hso-4(aq) + 3H+(aq) + 2e- → PBSO4(s) + 2h2Lub (l)
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Odunlade Emmanuel. (24 lipca 2018 r.). Różne rodzaje baterii i aplacje. Trawienie obwodu. Odzyskany z: Circuitdigest.com
- PRBA. (S.F.). Rodzaje baterii. Odzyskane z: PRBA.org
- Isidor Buchman. (2019). Jaka jest najlepsza bateria? Uniwersytet baterii. Źródło: Batteryniversity.com
- Firmy McGraw-Hill. (2007). Rozdział 12: Baterie. [PDF]. Odzyskane z: Oakton.Edu
- Shapley Patricia. (2012). Wspólne typy baterii. University of Illinois. Wyzdrowiał z: butanu.Chem.UIUC.Edu
- Postawa ekologiczna. (22 stycznia 2017 r.). Rodzaje akumulatorów: Ukończ prowadzenie z istniejącymi bateriami i akumulatorami. Źródło: ekcologiczny.com
- « Tomás Mejía Biografia, kariera wojskowa, strzelanie
- Bezwodne kwasowe Jak powstają, zastosowania i przykłady »

