Aminy

- 870
- 74
- Pani Gilbert Stolarczyk
Jakie są aminy?
aminy Są to związki organiczne pochodzące z amoniaku. W nich są kowalencyjne związki między węglem a azotem. Oczywiście cząsteczka azotu jest kinetycznie obojętna; Ale dzięki fiksacji biologicznej staje się amoniakiem, który z kolei cierpi z późniejszych reakcji alkilowania.
Kiedy amoniak jest „wynajęty”, zastępuje jeden, dwa lub trzy z trzech hydrogenów atomami węgla. Te węgle mogą pochodzić z grupy wynajmu (R) lub arylu (AR). Zatem istnieją aminy alifatyczne (liniowe lub rozgałęzione) i aromatyczne.
Aminy są silniejszymi zasadami organicznymi niż ten sam amoniak. Są łatwo zdejmowane z materii roślinnej i ogólnie mają silne interakcje z matrycą neuronalną organizmów; Stąd wiele leków i leków składa się z amin z złożonymi strukturami i podstawnikami.
Struktura aminy
 Ogólna formuła dla aminy. Źródło: Mache, Wikimedia Commons.
Ogólna formuła dla aminy. Źródło: Mache, Wikimedia Commons. Chociaż różni się w zależności od charakteru R, środowisko elektroniczne atomu azotu jest takie samo dla wszystkich: tetraedry. Ale mając kilka elektronów, które nie są dzielone na atomie azotu (··), geometria molekularna staje się piramidalna. Tak jest z amoniakiem i aminami.
Aminas mogą być reprezentowane za pomocą czworościanu, a także odbywa się z związkami węglowymi. Zatem NH3 i rozdz4 Są rysowane jak tetrahedry, gdzie para (··) znajduje się w jednym z wierzchołków powyżej azotu.
Obie cząsteczki są akwiralne; Jednak zaczynają prezentować chiralność, gdy ich H zastępuje. Amina r2NH jest akwiralny, jeśli dwa r są różne. Brakuje jednak żadnej konfiguracji w celu odróżnienia enancjomeru od innego (jak się dzieje z chiralnym centrami węgla).
Jest tak, ponieważ enancjomery:
R2N-H | H-nr2
Są one wymieniane z prędkością, tak że żadne z nich nie można izolować; i dlatego struktury amin są uważane za akwirały, nawet jeśli wszystkie podstawniki w atomie azotu są różne.
Właściwości aminy
Biegunowość
Aminy są związkami polarnymi, ponieważ grupa Amino NH2, Za atom azotu elektonegatywnego, przyczynia się do momentu dipolowego cząsteczki. Należy zauważyć, że azot ma zdolność do przekazywania wiązań wodorowych, które na ogół mają wysokie punkty gotowania i fuzji.
Charakterystyka fizyczna
W świecie chemii, mówiąc o amine, powstaje mimowolny akt zakrycia nosa. Wynika to z faktu, że zazwyczaj mają nieprzyjemne zapachy, z których niektóre wydają się z powodu zgniłych ryb.
Może ci służyć: reakcja MaillardPonadto płynne aminy mają zwykle żółtawe odcienie, które zwiększają nieufność wizualną, które generują.
Rozpuszczalność wody
Aminy zwykle są nierozpuszczalne w wodzie, ponieważ pomimo możliwości tworzenia mostów wodorowych za pomocą H₂O, jego większość organiczna jest hydrofobowa. Im bardziej nieporęczne lub długie grupy R, tym mniej będzie ich rozpuszczalność w wodzie.
Gdy jednak na środku występuje kwas, rozpuszczalność wzrasta przez tworzenie się tak zwanych soli aminowych. W nich azot ma dodatnie obciążenie częściowe, które przyciąga elektrostátycznie do podstawy anionu lub kwasu.
Zasadowość
Aminy są silniejszymi zasadami organicznymi niż amoniak. Im większa gęstość elektroniczna wokół atomu azotu, tym bardziej podstawowy będzie; Oznacza to, że kwasy pożywki będą szybciej zabezpieczyć. Jeśli amina jest bardzo podstawowa, może nawet wyrwać proton z alkoholi.
Typy (pierwotne, wtórne, trzeciorzędowe)
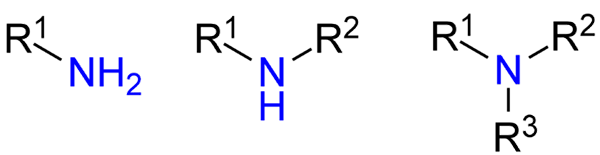 Rodzaje amin. Źródło: Jü przez Wikipedia.
Rodzaje amin. Źródło: Jü przez Wikipedia. Chociaż nie zostały one formalnie przedstawione, odniesiono odniesienie do amin pierwotnych, wtórnych i trzeciorzędowych (obraz górny, od lewej do prawej).
Pierwotne aminy (RNH2) są monosustuidami; Drugorzędny (r2NH), są rozpuszczane, z dwiema grupami romile lub arylowymi; i trzeciorzęd (r3N), są potrójne i brakuje wodoru.
Wszystkie istniejące aminy pochodzą z tych trzech rodzajów, więc ich różnorodność i interakcje z matrycą biologiczną i neuronalną są ogromne.
Ogólnie rzecz biorąc, można oczekiwać, że aminy trzeciorzędowe będą najbardziej podstawowe; Jednak takiego stwierdzenia nie można złożyć bez znajomości struktur r.
Tworzenie amin
Alkilowanie amoniaku
Na początku wspomniano, że aminy pochodzą z amoniaku; Dlatego najprostszym sposobem ich utworzenia jest ich alkilacja. Aby to zrobić, nadmiar amoniaku reaguje się na halogenku alkilu, a następnie dodanie podstawy do zneutralizowania soli aminowej:
NH3 + Rx => rnh3+X- => Rnh2
Zauważ, że te kroki prowadzą do pierwotnej aminy. Można również utworzyć aminy wtórne, a nawet trzeciorzędowe, więc wydajność dla pojedynczego produktu zmniejsza się.
Niektóre metody szkolenia, takie jak synteza Gabriela, pozwalają na uzyskanie pierwotnych amin, aby nie powstały inne niepożądane produkty.
Może ci służyć: alkohol etylowy: struktura, właściwości, zastosowania, uzyskiwaniePodobnie ketony i aldehydy mogą być zmniejszone w obecności amoniaku i pierwotnych amin, w celu zwiększenia amin wtórnych i trzeciorzędowych.
Katalityczne uwodornienie
Związki nitro można zmniejszyć w obecności wodoru i katalizatora, aby przekształcić się w odpowiednie aminy.
Arno2 => Rnah2
NITRILOS, RC≡N i amidas, rconr2, Są również redukowane, aby dać odpowiednio aminy pierwotne i trzeciorzędowe.
Nomenklatura
Jak nazywane są aminy? Przez większość czasu są nazywane zgodnie z R, Aquilo lub aryl Group. Do imienia r, pochodzącego od jego alkanów, słowo „amina” jest do niego dodawane w końcu.
Tak więc Ch3Ch2Ch2NH2 To jest propilamina. Z drugiej strony można go wyznaczyć tylko alkan, a nie jako grupa R: Propanamina.
Pierwszym sposobem nazwania ich jest tak samo znany i używany.
Gdy są dwie grupy NH2, Alkan jest mianowany, a pozycje grup aminowych są wymienione. Tak więc h2Nch2Ch2Ch2Ch2NH2 Nazywa się: 1.4-butanodiamina.
Jeśli istnieją grupy natlenione, takie jak OH, priorytet należy podać NH2, który zostaje mianowany zastępcą. Na przykład Hoch2Ch2Ch2NH2 nazywa się: 3-aminopropanol.
A w odniesieniu do amin wtórnych i trzeciorzędowych, n litery są wytwarzane w celu wskazania grup R. Najdłuższy łańcuch zachowa nazwę związku. Zatem Cho3Nhch2Ch3 Nazywa się to: N-metyloetyloamina.
Zastosowania amin
Barwniki
Pierwotne aminy aromatyczne mogą służyć jako materiał wyjściowy do syntezy barwników azowych. Początkowo aminy reagują na sole diazoniowe, które tworzą związki przez kopulację dachu (lub sprzężenie diazoiczne).
Ze względu na intensywne zabarwienie są one używane w przemyśle tekstylnym jako materiał do farbowania; Na przykład: pomarańczowy metyl, brązowy 138 bezpośredni, żółty zachód słońca i Ponceau.
Narkotyki i narkotyki
Wiele leków działa z agonistami i antagonistami naturalnych neuroprzekaźników aminowych. Przykłady:
-Chlorofeniramina jest przeciwhistaminą stosowaną w kontroli procesów alergicznych z powodu spożycia niektórych pokarmów, gorączki siana, żądła owadów itp.
-Chlorpromazyna jest środkiem uspokajającym, a nie induktorem snu. Łagodzi lęk, a nawet jest stosowany w leczeniu niektórych zaburzeń psychicznych.
-Efedryna i fenomfedryna są stosowane jako zmniejszanie przekrwienia dróg oddechowych.
Może ci służyć: osmolowość-Amitryptalina i imipramina są aminami trzeciorzędowymi, które są stosowane w leczeniu depresji. Trójcykliczne stożki przeciwdepresyjne są klasyfikowane według ich struktury.
-Opioidowe środki przeciwbólowe, takie jak morfina, kodelina i heroina, są aminami trzeciorzędowymi.
Obróbka gazowa
Kilka amin, w tym kopalokolamina (DGA) i dietedamin (DEA), jest stosowanych w eliminacji gazów dwutlenku węgla (CO2) i siarkowodór (h2S) obecny w gazie ziemnym i rafineriach.
Chemia rolnicza
Metilaminy są związkami pośrednikami w syntezie chemikaliów stosowanych w rolnictwie, takich jak herbicydy, fungicydy, środki owadobójcze i biocjdy.
Produkcja żywic
Podczas opracowania żywic wymiany jonowej stosuje się metilaminy, użyteczne w dejonizacji wodnej.
Zwierząt odżywczy
Trimetyloamina (TMA) stosuje się przede wszystkim w produkcji chlorku chlorku, suplementu witaminy B stosowanego w kurczakach, indykach i świnie.
Przemysł gumowy
Olej dimetyloaminy (DMA) jest emulgatorem do stosowania w produkcji gumy syntetycznej. DMA jest stosowany bezpośrednio jako modyfikator polimeryzacji w fazie parowej butadienu i jako stabilizator lateksu gumy naturalnej zamiast amoniaku
Rozpuszczalniki
Dimetyloamina (DMA) i monometyloamina (MMA) stosuje się do syntezy polowych rozpuszczalników polarnych czasowych (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP).
Wśród zastosowań DMF obejmują: powłoka uretanowa, rozpuszczalnik przędzy akrylowej, rozpuszczalniki reakcyjne i rozpuszczalniki ekstrakcyjne.
DMAC jest stosowany w produkcji barwników i rozpuszczalnika przędzy. Wreszcie NMP stosuje się w rafinacji olejków smarowych, odbioru i powłoki szkliwa.
Przykłady amin
Kokaina
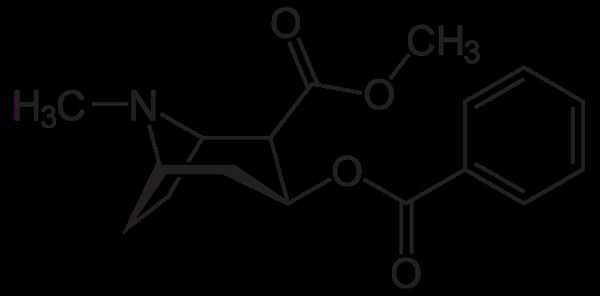 Cząsteczka kokainy. NeuroTokeker, Wikimedia Commons
Cząsteczka kokainy. NeuroTokeker, Wikimedia Commons Kokaina jest stosowana jako miejscowa znieczulenie w niektórych rodzajach operacji oczu, uszy i gardła. Jak widać, jest to trzeciorzędowa amina.
Nikotyna
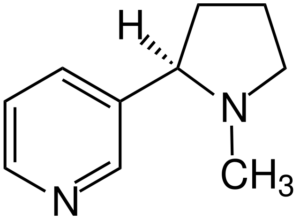 Cząsteczka nikotyny. Źródło: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons
Cząsteczka nikotyny. Źródło: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons Nikotyna jest głównym czynnikiem uzależnienia od tytoniu i chemicznie trzeciorzędowym aminą. Nikotyna obecna w dymie tytoniowym jest szybko wchłaniana i jest wysoce toksyczna.
Morfina
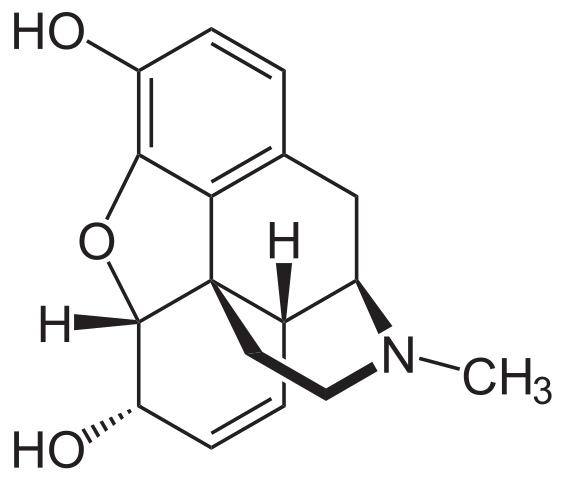 Cząsteczka morfiny. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons
Cząsteczka morfiny. Źródło: Neuropoger [domena publiczna], z Wikimedia Commons Jest to jeden z najskuteczniejszych środków przeciwbólowych do łagodzenia bólu, zwłaszcza raka. To znowu trzeciorzędna amina.
Serotonina
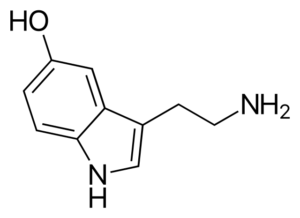 Cząsteczka serotoniny. Źródło: Harbin [domena publiczna], z Wikimedia Commons
Cząsteczka serotoniny. Źródło: Harbin [domena publiczna], z Wikimedia Commons Serotonina jest neuroprzekaźnikiem aminowym. U pacjentów z depresją stężenie głównego metabolitu serotoniny jest zmniejszone. W przeciwieństwie do innych amin, jest to pierwotne.
Bibliografia
- Metyloamin: zastosowania i zastosowania. Odzyskane z: chemours.com
- Badania rynku przejrzystości. (S.F.). Aminy: ważne fakty i zastosowania. Odzyskane z: przezrorencyMarkEtresearch.com

