Octan etylu
- 3699
- 1129
- Prokul Woliński
On octan etylu lub etylu Jest to związek organiczny, którego wzorem chemicznym jest Cho3COOC2H5. Składa się z estru, w którym składnik alkoholowy wywodzi się z etanolu, podczas gdy jego składnik kwasu karboksylowego pochodzi z kwasu octowego.
Jest ciecz w normalnych warunkach temperatury i ciśnienia, przedstawiając aromat przyjemny dla owoców. Ta nieruchomość wchodzi idealnie w harmonii, więc oczekuje się od estra; który w rzeczywistości jest chemiczny charakter octanu etylu. Z tego powodu znajduje się w produktach spożywczych i napojach alkoholowych.
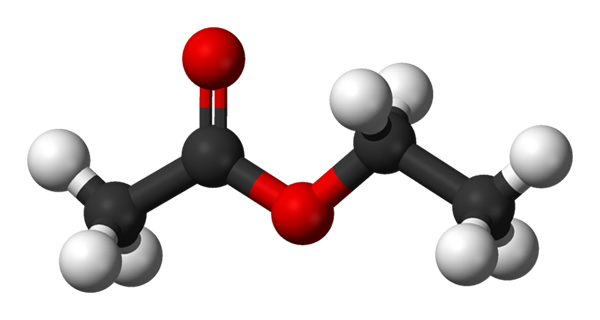
 Octan etylu. Źródło: Commons Wikimedia.
Octan etylu. Źródło: Commons Wikimedia. Górny obraz pokazuje strukturę szkieletu acetatodu etylu. Zwróć uwagę na składnik kwasu karboksylowego, a po prawej składnik alkoholowy. Z strukturalnego punktu widzenia można oczekiwać, że związek ten będzie zachowywał się jak hybryda między ocetem a alkoholem; Jednak wykazuje własne nieruchomości.
W tym miejscu takie hybrydy zwane estrami wyróżniają się, że są inne. Octan etylu nie może reagować jak kwas, ani odwodnić przez brak grupy OH. Zamiast tego cierpi z podstawową hydrolizę w obecności silnej zasady, takiej jak wodorotlenek sodu, NaOH.
Ta reakcja hydrolizy jest stosowana w nauczaniu laboratoriów do eksperymentów kinetyki chemicznej; gdzie reakcja jest ponadto drugim rzędem. Gdy zachodzi hydroliza, etanoan Ethila.
W swoim szkielecie strukturalnym obserwuje się, że atomy wodoru na tlenu dominują. Wpływa to na jego zdolność do interakcji z gatunkami polarnymi jak tłuszcze. Służy również do rozpuszczenia związków, takich jak żywice, barwniki i ogólnie organiczne stałe.
Pomimo przyjemnego aromatu, przedłużająca się ekspozycja na tę ciecz generuje negatywny wpływ (jak prawie wszystkie związki chemiczne) na organizm.
Struktura octanu etylu
 Model sfer i słupków do octanu etylu. Źródło: Benjah-BMM27 [domena publiczna]
Model sfer i słupków do octanu etylu. Źródło: Benjah-BMM27 [domena publiczna] Górny obraz pokazuje strukturę octanu etylu z modelem kul i słupków. W tym modelu podkreślono atomy tlenu z czerwonymi kulami; Po jego lewej stronie znajduje się frakcja pochodząca z kwasu, a po prawej części frakcji pochodząca z alkoholu (alkohoxi, -OR).
Może ci służyć: słabe elektrolity: koncepcja, cechy, przykładyGrupę karbonylową można zobaczyć za pomocą linku C = O (podwójne słupki). Struktura wokół tej grupy i sąsiedni tlen jest płaski, ponieważ istnieje przeniesienie obciążenia rezonansowego między obiema tlenem; Fakt, że wyjaśnia stosunkowo niską kwasowość hydrogenów α (te z grupy -ch3, powiązane z C = O).
Cząsteczka, obracająca dwa z jej linków, bezpośrednio sprzyja interakcjom z innymi cząsteczkami. Obecność dwóch atomów tlenu i asymetrii w strukturze nadają mu stały moment dipolowy; który z kolei jest odpowiedzialny za interakcje dipol-dipol.
Na przykład gęstość elektroniczna jest większa w pobliżu dwóch atomów tlenu, znacznie zmniejszając się w grupie -ch3, I stopniowo w grupie OCH2Ch3.
Z powodu tych interakcji cząsteczki octanu etylu tworzą ciecz w normalnych warunkach, która ma znacznie wysoką temperaturę wrzenia (77ºC).
Brak darczyńców atomów mostów wodorowych
Jeśli struktura zostanie starannie obserwowana, zauważono brak atomu zdolnego do przekazania mostu wodorowego. Jednak atomy tlenu są akceptorami takich, a octan etylu jest bardzo rozpuszczalny w wodzie i oddziałuje w szacowanym stopniu z związkami polarnymi i dawcami mostów wodorowych (takich jak cukry).
Pozwala także doskonale współdziałać z etanolem; Powód, dla którego jego obecność w napojach alkoholowych nie jest zaskoczona.
Z drugiej strony jego grupa Alcoxi sprawia, że jest w stanie wchodzić w interakcje z niektórymi związkami apolarnymi, takimi jak chloroform, ch3Cl.
Fizyczne i chemiczne właściwości
Nazwy
-Octan etylu
-Etylu etanoan
-Octowy etyl
-Acetoksietano
Formuła molekularna
C4H8ALBO2 lub Ch3COOC2H5
Waga molekularna
88 106 g/mol.
Opis fizyczny
Przezroczysta bezbarwna płyn.
Kolor
Bezbarwny płyn.
Zapach
Charakterystyczne dla eterów, podobne do zapachu ananasa.
Smak
Ładnie po rozcieńczeniu, przynosi do piwa smak owoców.
Zapach próg
3,9 ppm. 0,0196 mg/m3 (niski zapach); 665 mg/m3 (Wysoki zapach).
Może ci służyć: wiązanie chemiczneUstalany zapach przy 7-50 ppm (średnia = 8 ppm).
Punkt wrzenia
171 ° F przy 760 mmHg (77,1 ºC).
Temperatura topnienia
-118,5 ° F (-83,8 ° C).
Rozpuszczalność wody
80 g/l.
Rozpuszczalność w rozpuszczalnikach organicznych
Mieszalne z etanolem i eterem etylowym. Bardzo rozpuszczalny w acetonie i benzenie. Mieszalne z chloroformem, stałymi olejami i lotnymi, a także z natlenionymi i chlorowanymi rozpuszczalnikami.
Gęstość
0,9003 g/cm3.
Gęstość pary
3.04 (w relacji powietrznej: 1).
Stabilność
Powoli rozkłada się z wilgocią; niezgodne z kilkoma silnymi tworzywami utleniającymi i agentami. Mieszanina z wodą może być wybuchowa.
Ciśnienie pary
93,2 mmHg w 25 ° C
Breja
0,423 mpoise w 25 ° C.
Ciepło spalania
2.238,1 kJ/mol.
Ciepło parowe
35,60 kJ/mol w 25 ° C.
Napięcie powierzchniowe
24 dynami/cm przy 20 ° C.
Współczynnik załamania światła
1 373 do 20 ° C/D.
Temperatura przechowywania
2 - 8 ºC.
PKA
16 - 18 do 25 ºC.
Synteza
Reakcja Fishera
Octan etylu jest przemysłowo syntetyzowany przez reakcję Fishera, w której etanol jest estryfikowany za pomocą kwasu octowego. Reakcja odbywa się w temperaturze pokojowej.
Ch3Ch2OH +CH3Cooh ch3Cooch2Ch3 + H2ALBO
Reakcja jest przyspieszana przez kataliza kwasu. Równowaga porusza się w prawo, to znaczy w kierunku produkcji octanu etylu, usuwając wodę; Zgodnie z prawem masowym.
Reakcja Tishchenko
Octan etylu jest również przygotowywany przemysłowo przy użyciu reakcji Tishchenko, koniugując dwa równoważniki acetaldehydu z zastosowaniem katalizatora jako katalizatora.
2 Ch3Cho => Cho3Cooch2Ch3
Inne metody
-Octan etylu jest syntetyzowany jako produkt co -produktu w utlenianiu butanu do kwasu octowego, w reakcji dokonanej w temperaturze 175 ° C i 50 atm ciśnienia. Jest stosowany jako kobaltowy katalizator i jony chromowe.
-Octan etylu jest produktem CO -Polylinyl poliwinylu octanu octanu winylu.
-Octan etylu jest również wytwarzany w branży przez odwodornienie etanolu, katalizując reakcję za pomocą miedzi w wysokiej temperaturze, ale mniej niż 250 ° C.
Aplikacje
Rozpuszczalnik
Octan etylu jest używany jako rozpuszczalnik i rozcieńczający, używając czyszczenia płyt obwodowych. Jest stosowany jako rozpuszczalnik w produkcji zmodyfikowanego ekstraktu chmielu, a w bezkofeinowych liściach kawy i herbaty. Jest używany w atramentach używanych do oznaczania owoców i warzyw.
Może ci służyć: kwas cyjanhydowy: struktura molekularna, właściwości, zastosowaniaOctan etylu jest używany w przemyśle tekstylnym jako środek czyszczący. Stosuje się w kalibracji termometrów, stosowanych w separacji cukrów. W branży malarskiej jest używany jako rozpuszczalnik i rozcieńczalnik używanych materiałów.
Sztuczne smaki
Jest używany w opracowaniu smaków owocowych; Na przykład: banan, gruszka, brzoskwinia i ananas, a także aromat winogron itp.
Analityka
Jest stosowany w określeniu bizmutów, boru, złota, molibdenu i platyny, a także rozpuszczalnika talium. Octan etylu ma zdolność do wydobywania wielu związków i pierwiastków obecnych w roztworze wodnym, takich jak: fosfor, kobalt, wolfram i arsen.
Synteza organiczna
Octan etylu jest stosowany w branży jako reduktor lepkości żywic stosowanych w preparatach fotograficznych. Jest stosowany w produkcji acetamidu, octanu acetylu i heptanonie metylu.
Chromatografia
W laboratoriach octan etylu jest używany jako mobilna faza chromatografii w kolumnach i jako rozpuszczalnik ekstrakcyjny. Mając octan etylu stosunkowo niską temperaturę wrzenia, łatwo jest odparować, co pozwala skoncentrować substancje rozpuszczone w rozpuszczalniku.
Entomologia
Octan etylu jest wykorzystywany w entomologii do uduszania owadów umieszczonych w pojemniku, umożliwiając jego zbieranie i badanie. Opary etylu octanu zabijają owada, nie niszcząc go i nie unikając stwardnienia, ułatwiając montaż kolekcji.
Ryzyko
-Ldpięćdziesiąt Z octanu etylu u szczurów wskazuje na niską toksyczność. Może jednak podrażniać skórę, oczy, skórę, nos i gardło.
-Ekspozycja na wysokie poziomy może powodować zawroty głowy i omdlenia. Podobnie długoterminowe narażenie może wpływać na wątrobę i nerki.
-Inhalacja octanu etylu w stężeniu 20.000 - 43.000 ppm, może wytwarzać obrzęk płuc i krwotok.
-Limit wystawy pracy został ustalony przez OSHA na 400 ppm w powietrzu, średnio podczas 8 -godzinnej zmiany pracy.
Bibliografia
- Ilustrowany glosariusz chemii organicznej: octan etylu (EtOAC). Odzyskane z: chem.UCLA.Edu
- Octan ethylu. Źródło: CHM.Bris.AC.Wielka Brytania

