Amidas
- 2182
- 598
- Filip Augustyn
Wyjaśniamy, jakie są ich cechy, struktura, typy, nomenklatura i podajemy kilka przykładów
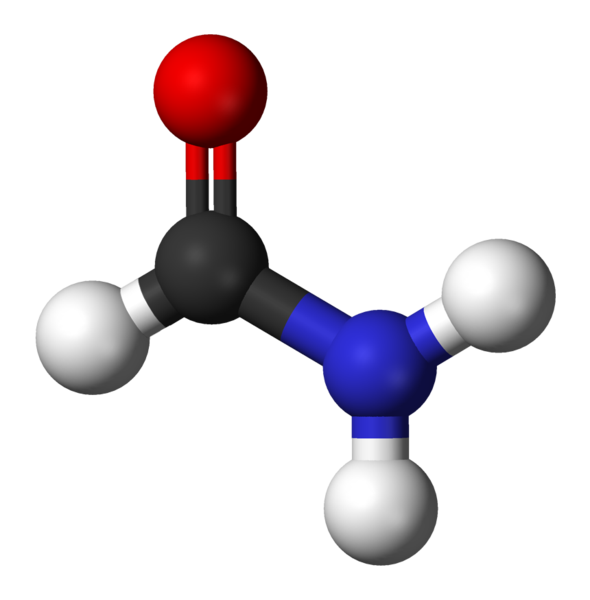
 Formamid, najprostsza Amida
Formamid, najprostsza Amida Co to są Amidas?
Amidas są rodzajem związków organicznych, które powstają przez zjednoczenie między kwasem karboksylowym a aminą. Nazywane są również kwasowymi aminami i stamtąd właśnie tam pochodzi słowo amid.
Te związki są bardzo ważne dla życia, ponieważ są istotną częścią białek, peptydów i niektórych hormonów. Są również częścią azotowych zasad DNA i RNA, które zawierają nasze informacje genetyczne.
Amidas są również bardzo ważne w branży. Na przykład, Nylon Jest to jeden z najczęściej używanych włókien syntetycznych na całym świecie i jest tworzony przez długi łańcuch zjednoczonych amidów jeden po drugim.
Ponadto amidy są często używane w branży farmaceutycznej, ponieważ są częścią leków, takich jak lidokaina.
Charakterystyka amidów
- Prawie wszystkie są solidne: Wszystkie amidy są solidne w temperaturze pokojowej, z wyjątkiem najmniejszego i najprostszego, jakim jest formamid. Ten ostatni jest płynny.
- Mają wysoką temperaturę wrzenia: W porównaniu z kwasami karboksylowymi i aminami, z których są wytwarzane, amidy mają wysoką temperaturę wrzenia. Na przykład acetamid (wybierz3Conh2) Powstaje przez połączenie kwasu octowego (octu) z amoniakiem. Temperatura wrzenia acetamidu wynosi 221,2 ° C, podczas gdy kwas octowy wynosi 118 °.
- Niektóre są rozpuszczalne w wodzie: Najmniejsze amidas dobrze wymieszaj z wodą, więc łatwo je rozpuścić. Jednak gdy stają się większe, stają się mniej rozpuszczalne.
- Są mniej podstawowe niż aminy: Amida jest zawsze mniej podstawowa (lub bardziej kwaśna) niż amina, z której pochodzi. W rzeczywistości nazwa Amida pochodzi z połączenia JaNa+ACIdaje.
- Twój link można łatwo złamać: Jeśli dodana jest silna baza jako katalizator, amidy szybko reagują z wodą. Ta reakcja nazywa się hydrolizą i w tym samym, amida jest zepsuta, tworząc oryginalny kwas i aminę.
- Są to bezbarwne i toalety: Ogólnie rzecz biorąc, amidy są substancjami, które nie mają koloru ani charakterystycznego zapachu.
Funkcjonalna struktura grupy
Chemicznie Amida jest grupą funkcjonalną, która zawiera grupę karbonylową (C = O) z kwasu karboksylowego, powiązana z azotem z amoniaku lub aminy. Ogólna struktura amidów to:
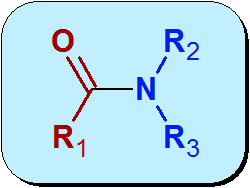 Czerwona część cząsteczki na poprzednim obrazie pochodzi z kwasu karboksylowego i nazywa się Acyl. Niebieska część pochodzi z Amidy.
Czerwona część cząsteczki na poprzednim obrazie pochodzi z kwasu karboksylowego i nazywa się Acyl. Niebieska część pochodzi z Amidy.
Charakterystyką dla struktury Amids, która odróżnia ich od amin, polega na tym, że para wolnych elektronów, które azot jest właścicielem z grupą karbonylową poprzez proces zwany rezonansem. To sprawia, że pośród mniej podstawowych niż aminy.
Rodzaje amidów
W zależności od tego, czy kwas jest łączony z amoniakiem, z pierwotną aminą lub wtórną aminą, można uzyskać trzy typy amidów o różnych strukturach:
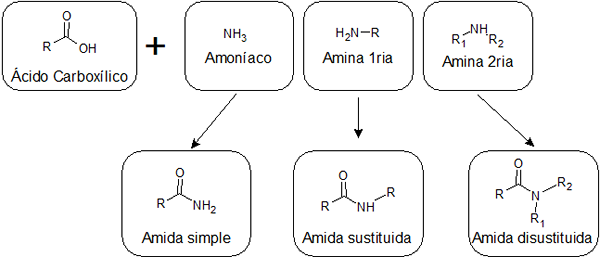
Proste amidy
Są one tworzone przez związek między kwasem karboksylowym a amoniakiem. Ten rodzaj amida ma grupę -NH2 Powiązane z grupą karbonylową. Proste amidy mogą tworzyć kilka wiązań wodorowych ze sobą i z wodą, więc zwykle są bardziej rozpuszczalne niż te zastąpione.
- Proste przykłady amidy: formamid, acetamid i butyramid.
Zastąpione amidy
Są one uzyskiwane przez połączenie kwasu i pierwotnej aminy. W tym przypadku jeden z hydrogenów -NH2 Prostych amidów jest zastępowane przez alkil i dlatego powiedziano im, że wymieniono.
- Przykład zastąpionego amidu: Związek między aminokwasami w białkach.
Niedarbowane amidy
Pochodzą z reakcji między kwasem a wtórną aminą. W tym przypadku oba hydrogeny grupy -NH2 Są one zastępowane grupami alkilowymi. Nieprawdzone amidy nie mają przyłączonego wodoru do nitrogenów, więc nie mogą tworzyć ze sobą mostów wodoru i tylko jeden słaby z wodą. To sprawia, że są mniej rozpuszczalne w wodzie niż inne rodzaje amidów.
Lactamas, pierwotne, wtórne i trzeciorzędowe
Oprócz trzech rodzajów nowo wymienionych amidów, istnieją również Amidy pierwotne, wtórne i trzeciorzędowe, różnią się tym, mając jedną, dwie lub trzy kwaśne grupy zjednoczone z atomem azotu.
Wreszcie, niektóre amidy tworzą zamknięte cykle. W takim przypadku związek jest nazywany Lactam. Laktamie są bardzo ważne z natury. Na przykład uracyl, który jest częścią RNA, jest laktamem.
Nomenklatura Amidas
Proste amidy
Proste amidy są nazwane od nazwy łańcucha węglowego kwasu, z którego pochodzą (główny łańcuch). Nazwa jest zbudowana przez umieszczenie prefiksu wskazującego liczbę węgli (metan-, butan-, heksan itp.) lub wspólna nazwa kwasu poprzez usunięcie zakończenia -oico lub -ico (jak w Acéti co) I dodanie zakończenia -amida.
- Przykład: amid pochodzący z kwasu octowego, nazywa się acetamid.
Zastąpione i niepożądane amidy
W tym przypadku zaczyna się od powołania grup alkilowych zjednoczonych z azotem, poprzedzonym literą n-. Następnie reszta Amida jest nazwana głównym łańcuchem.
Może ci służyć: siarka: historia, właściwości, struktura, uzyskiwanie, użyciaPrzykład:
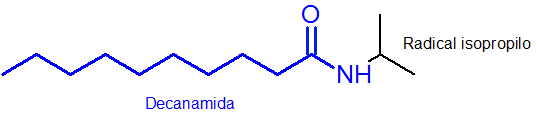 Jak widać, podstawnik przymocowany do azotu jest grupa izopropylowa, więc jest on zawarty w nazwie n-omopropylu (ostatni „O” jest zawsze usuwany do nazwy rodnika).
Jak widać, podstawnik przymocowany do azotu jest grupa izopropylowa, więc jest on zawarty w nazwie n-omopropylu (ostatni „O” jest zawsze usuwany do nazwy rodnika).
Reszta głównego łańcucha, która ma grupę funkcjonalną amida, ma 10 atomów węgla. To znaczy, twoje imię musi mieć dekan przedrostek- a następnie zakończenie amida lub dekanamid. Więc on Pełna nazwa to N-Osopropildecanamid.
Przykłady amidów
- Benzamid c6H5Conh2
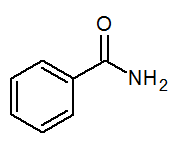
- N, n-dimetyloacetamid ch3Z (ch3)2
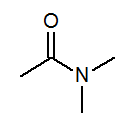
- Acetamid ch3Conh2
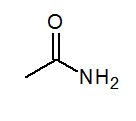
- Fenyloacetamid (c6H5) Ch2Conh2
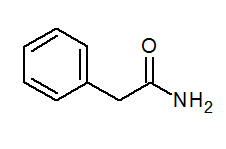
- N-butil-n-propilformamide HCON (c3H7) (C4H9)
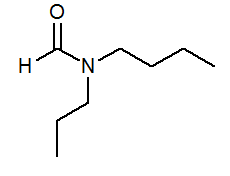
- 4-hydroksybanamid ch2(Oh) Cho2Ch2Conh2
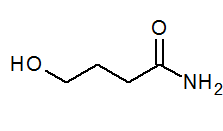
- Mocznik (NH2)2
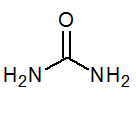
- Propanamid ch3Ch2Conh3
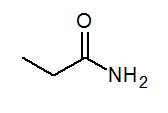
- N-butil-2-echopilpetanamida ch3Ch2Ch2CH (c3H7) Conh (c4H9)

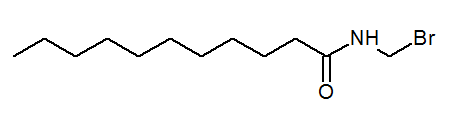
- N- (bromometylo) undekanamid cho3(Ch2)9Conhch2Br
Bibliografia
- Britannica, t. Redaktorzy Encyclopaedia (2019, 15 maja). Amid. Britannica Encyclopedia. Zaczerpnięte z Britannica.com
- Azis- struktury i nazwy. (2020, 17 sierpnia). Pobrane z chemii.Librettexts.org
- Carey, f. DO. (2008). Chemia organiczna. Boston: szkolnictwo wyższe McGraw-Hill.
- Smith, m., Marzec, J., & March, J. (2001). Zaawansowana chemia organiczna marcowego: reakcje, mechanizmy i pasek. Nowy Jork: Wiley.
- Zabicky, J. (1970). Chemia AMI, część 1. Nowy Jork: Wiley

