Aldehydes

- 4687
- 926
- Maksymilian Kępa
Jakie są aldehydy?
Aldehydes Są to związki organiczne, które mają ogólną formułę RCHO. R reprezentuje łańcuch alifatyczny lub aromatyczny; C Carbon; Lub tlen i wodór H. Charakteryzują się posiadaniem grupy karbonylowej, takiej jak ketony i kwasy karboksylowe, więc aldehydy są również nazywane związkami karbonylowymi.
Grupa karbonylowa daje aldehyd wiele jego właściwości. Są to związki, które są łatwo utleniane i są bardzo reaktywne na dodatki nukleofilowe. Podwójne wiązanie grupy karbonylowej (C = O) przedstawia dwa atomy, które mają różnice w ich ucholumności przez elektrony (elektroonyczność).
Tlen przyciąga elektronę silniej niż węgiel, więc chmura elektroniczna porusza się w jego kierunku, wykonując podwójne wiązanie między węglem a tlenem o charakterze polarnym, z ważnym momentem dipolowym. To sprawia, że aldehydo.
Innymi słowy, aldehydo są rodzajem związków organicznych wynikających z utleniania niektórych alkoholi.
Struktura chemiczna aldehydów
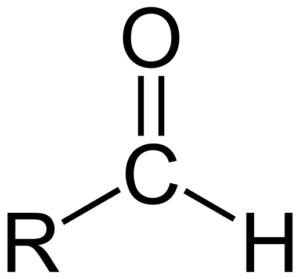 Struktura chemiczna aldehydów
Struktura chemiczna aldehydów Aldehydo składają się z karbonylu (C = O), z którym atom wodoru jest bezpośrednio połączony. Odróżnia go od innych związków organicznych, takich jak ketony (r2C = O) i kwasy karboksylowe (RCOOH).
Górny obraz pokazuje strukturę molekularną wokół -cho, grupy. Grupa wzoru jest płaska, ponieważ węgiel i tlen mają hybrydyzację SP2. Ta płaszczyzna sprawia, że jest podatna na atak gatunków nukleoficznych, a zatem można ją łatwo utleniać.
Co oznacza takie utlenianie? Do tworzenia łącza z dowolnym innym atomem elektroonegatywnym niż węgiel; Aw przypadku aldehydos jest to tlen. Zatem aldehyd utlenia kwas karboksylowy, -coh. Co jeśli aldehyd został zmniejszony? Zamiast tego powstałby pierwotny alkohol, Roh.
Aldehydo występują tylko z pierwotnych alkoholi: te, w których grupa OH znajduje się na końcu łańcucha. Podobnie grupa formilowa zawsze Jest na końcu łańcucha lub wyróżnia się od niego lub pierścienia jako podstawnik (jeśli istnieją inne ważniejsze grupy, takie jak -cooh).
Właściwości fizyczne i chemiczne aldehydów
Będąc związkami polarnymi, ich temperatury topnienia są większe niż w przypadku związków nie -spolarnych. Cząsteczki aldehydosów nie są w stanie wiązać międzycząsteczowo przez mosty wodorowe, ponieważ mają tylko atomy węgla zjednoczone z atomami wodoru.
Z powodu powyższego aldehydy mają niższe temperatury wrzenia niż alkohole i kwasy karboksylowe.
Punkty fuzji
Formaldehyd -92; Acetaldehyd -121; Proponicaldehyd -81; n- butiraldehyd -99; N -Valeraldehyd -91; Kaproaldehyd -; Heptaldehyd - 42; Fenyloacetaldehyd -; Benzaldehyd -26.
Punkty wrzenia
Formaldehyd -21; Acetaldehyd 20; Proponcjonalny hyd 49; N-Butialdehido 76; N-Valaleraldehyd 103; Kaproaldehyd 131; Heptaldehyd 155; Fenyloacetaldehyd 194; Benzaldehyd 178.
Może ci służyć: określone właściwości materii: co to jest i przykładyRozpuszczalność w wodzie wyrażona w g/100 g h2ALBO
Formaldehyd, bardzo rozpuszczalny; Acetaldehyd, nieskończony; Proponsionaldehyd, 16; N-butialdehyd, 7; N-wlalealdehyd, lekko rozpuszczalny; Kaproaldehyd, lekko rozpuszczalny; Fenyloacetaldehyd nieco rozpuszczalny; Benzaldehyd, 0,3.
Temperatury wrzenia aldehydo mają tendencję do wzrostu bezpośrednio wraz z masą cząsteczkową. Przeciwnie, istnieje tendencja do zmniejszania rozpuszczalności aldehydów w wodzie wraz ze wzrostem masy cząsteczkowej. Znajduje to odzwierciedlenie w fizycznych stałych nowo wymienionych aldehydów.
Reaktywność aldehydów
Reakcja utleniania
Aldehydes mogą utleniać odpowiedni kwas karboksylowy w obecności dowolnego z tych związków: Ag (NH3)2, Kmno4 Dobra2Cr2ALBO7.
Redukcja alkoholi
Mogą sami uwodnić za pomocą katalizatorów niklu, platyny lub paladu. Zatem C = O jest przekształcane w C-OH.
Redukcja do węglowodorów
W obecności Zn (Hg), skoncentrowanego HCl lub w NH2NH2 Aldehydo tracą grupę karbonylową i stają się węglowodorami.
Dodatek nukleofilowy
Istnieje kilka związków dodawanych do grupy karbonylowej, w tym: Grignard, odczynniki cyjanku, pochodne amoniak.
Nomenklatura Aldehydos
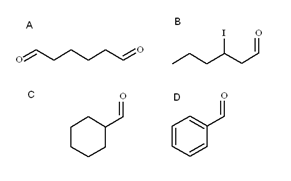 Cztery aldehydy. Źródło: Gabriel Bolívar
Cztery aldehydy. Źródło: Gabriel Bolívar Na górnym obrazie zilustrowano cztery aldehydo. Jak są nazywani?
Ponieważ są to zardzewiałe alkohole pierwotne, nazwa alkoholu zmienia się z zakończeniem -ol przez -al. Tak więc metanol (wybierz3Och) Jeśli utlenie się do Cho3Cho nazywa się metanal (formaldehyd); Ch3Ch2Cho Etanal (acetaldehyd); Ch3Ch2Ch2Cho Propanal i Cho3Ch2Ch2Ch2Butanal Cho.
Wszystkie nowo nazwane aldehydo mają grupę -cho na końcu łańcucha. Kiedy jest to na obu końcach, jak na, na końcu -do niego dodaje się przedrostek di-. Podobnie jak sześć węgli (liczenie tych z obu grup formylowych), wywodzi się z 1-heksanolu, a jego nazwa to: heksanWybierz.
Gdy istnieje podstawnik, taki jak rodnik alquiliczny, podwójny lub potrójny link lub halogen, węglowodory głównego łańcucha są wymienione, podając numer 1. Zatem aldehyd B nazywa się: 3-jodheksanal.
Jednak w aldehydach C i D grupa -cho nie ma priorytetu do identyfikacji tych związków innych. C jest cykloalcano, a d a benzen, oba z jednym z jego zastępowanym przez grupę formilową.
W nich, ponieważ główna struktura jest cykliczna, grupa formuli nazywa się karbaldehydem. Zatem C jest cykloheksanokbaldehydem, a D benzenokarbaldehyd (lepiej znany jako benzaldehyd).
Zastosowania aldehydów
Istnieją aldehydy w naturze, które zdolne do przyznaczenia przyjemnych smaków, takie jak w przypadku cynamaldehydu, odpowiedzialnego za charakterystyczny smak cynamonu. Dlatego są one zwykle używane jako sztuczne aromatyzacje w wielu produktach, takich jak słodycze lub jedzenie.
Formaldehyd
Formaldehyd jest aldehydem, który występuje przemysłowo w większej ilości. Formaldehyd uzyskany przez utlenianie metanolu jest stosowany w 37% roztworze gazu w wodzie, pod nazwą formaliny. Jest to stosowane w opalaniu skór oraz w ochronie i balsamowaniu zwłok.
Może ci służyć: octan sodu: struktura, właściwości, synteza, zastosowaniaFormaldehyd jest również stosowany jako blemucydy, fungicydy i środki owadobójcze dla roślin i warzyw. Jednak jego największą użytecznością jest wkład w produkcję materiału polimerowego. Plastik zwany bakelita jest syntetyzowany przez reakcję między formaldehydem a fenolem.
Bakelita
Bakelita to świetny, twardy -wymiarowy polimer struktury stosowany w wielu przyborkach domowych, takich jak garnki, patelnie, producenci kawy, noże itp.
Polimery podobne do bakelita są wytwarzane z formaldehydu w połączeniu z związkami mocznika i melaminy. Te polimery są używane nie tylko jako tworzywa sztuczne, ale są również stosowane jako patyczki i materiał powłoki.
Sklejka
Sklejka to komercyjna nazwa materiału utworzonego przez cienkie arkusze drewna, połączone polimery wytwarzane z formaldehydu. Marki formalne i Melmac są produkowane wraz z udziałem tego. Morski to materiał z tworzywa sztucznego używanego w powładzie meblowej.
Plastik MMLMAC jest używany do opracowania płyt, okularów, kubków itp. Formaldehyd jest surowcem do syntezy związku metylen-difenil-diisocianate (MDI), prekursor poliuretanu.
Poliuretan
Poliuretan jest używany jako izolator w lodówkach i zamrażarkach, wyściełany do mebli, materacy, powłok, klejów, podeszwy itp.
Butialdehyd
Butialdehyd jest głównym prekursorem syntezy 2-etyloheksanolu, który jest używany jako plastyfikator. Ma przyjemny aromat jabłek, który umożliwia jego wykorzystanie w jedzeniu jako aromaty.
Jest również używany do gumowych akceleratorów. Interweniuje jako pośrednie odczynnik w produkcji rozpuszczalników.
Acetaldehyd
Acetaldehyd zastosowano do produkcji kwasu octowego. Ale ta funkcja acetaldehydu zmniejszyła się, ponieważ została przesunięta przez proces karbonilacji metanolu.
Synteza
Inne aldehydy są prekursorami oksoalkoholów, które są stosowane w produkcji detergentów. SAK -podsumowane oksylkohole są przygotowywane przez dodanie węgla i tlenku wodoru do olefiny w celu uzyskania aldehydu. I wreszcie aldehyd jest wodorem w celu uzyskania alkoholu.
Niektóre aldehydo są stosowane w produkcji perfum, takich jak Chanel nr 5. Na przykład wiele naturalnych aldehydów ma przyjemne zapachy: heptanal ma zapach zielonej trawy; Octanal, zapach pomarańczy; Nieanowy, zapach róż i cytrala, zapach limu.
Przykłady aldehydów
Glutaraldehyd
 Glutaraldehyd. Źródło: Jynto [CC0], z Wikimedia Commons
Glutaraldehyd. Źródło: Jynto [CC0], z Wikimedia Commons Glutaraldehyd przedstawia w swojej strukturze dwie grupy formylowe na obu końcach.
Sprzedawany pod nazwą CIDEX lub Glutararal, jest używany jako środki dezynfekujące do sterylizacji instrumentów chirurgicznych. Jest stosowany w leczeniu brodawek na stopach, stosując się jako płyn.
Jest również stosowany jako środek mocujący tkaninę w laboratoriach histologii i patologii.
Może ci służyć: siarczan miedzi (CUSO4): struktura, właściwości, uzyskiwanie, użyciaBenzaldehyd
Jest to najprostszy aromatyczny aldehyd, który jest tworzony przez pierścień benzen.
Występuje w oleju migdałowym, stąd jego charakterystyczny zapach, który pozwala na jego użycie jako aromatyzowanie żywności. Ponadto jest stosowany w syntezie związków organicznych związanych z produkcją leków i opracowania tworzyw sztucznych.
Gliceraldehyd
Jest to aldotriosa, cukier składający się z trzech atomów węgla. Przedstawia dwa izomery nazywane enancjomerami D i L. Gliceraldehyd jest pierwszym monosacharydem uzyskanym w fotosyntezy podczas fazy ciemnej (Calvin Cycle).
Gliceraldehyd-3-fosforan
 Gliceraldehyd. Źródło: Jynto i Ben Mills
Gliceraldehyd. Źródło: Jynto i Ben Mills Na lepszym obrazie ilustrują strukturę gliceraldehydu-3-fosforanu. Czerwone kule obok żółtego odpowiadają grupie fosforanowej, a czarny do szkieletu węglowego. Czerwona kula połączona z Blanca to grupa OH, ale kiedy czarna kula jest połączona, a ta ostatnia z białą, to jest to grupa Cho.
Gliceraldehyd-3-fosforan interweniuje w glikolizy, proces metaboliczny, w którym glukoza jest degradowana do kwasu piruwicznego z wytwarzaniem ATP, zbiornika energetycznego żywych istot żywych istot. Oprócz produkcji NADH, biologiczny środek redukujący.
W glikolehydu-3-fosforanowej i fosforanowej fosforanowej i fosforan dihydroaceton są spowodowane przez d-frucease-6-6-fosforan D-frucease-6-6.
Fosforan gliceraldehydu-3 interweniuje w procesie metabolicznym znanym jako cykl pentozowy. W tym wygenerowana jest NADPH, ważny reduktor biologiczny.
11 -CIS -RETIN
 11 -CIS -RETIN
11 -CIS -RETIN Β-karoten jest naturalnym pigmentem obecnym w kilku warzywach, szczególnie w marchwi. Doświadczyć przerwy oksydacyjnej w wątrobie, przekształcając w ten sposób alkohol retinolu lub witaminę A. Utlenianie witaminy A, a następnie izomeryza.
Fosforan pirydoksalny (witamina B6)
 Fosforan pirydoksalny lub witamina B6. Źródło: Jynto i Ben Mills.
Fosforan pirydoksalny lub witamina B6. Źródło: Jynto i Ben Mills. Jest to grupa protetyczna przyłączona do kilku enzymów, która jest aktywną postacią witaminy B6 i uczestniczy w procesie syntezy hamującego neuroprzekaźnika GABA.
Gdzie jest grupa formuli w jej strukturze? Zauważ, że różni się to od reszty grup połączonych z pierścieniem aromatycznym.
Salidehyd
Jest to surowiec do syntezy kwasu acetylosalicylowego, lekarstwa przeciwbólowego i przeciwdziałającego przeciwbólowym znanym jako aspiryna.
Bibliografia
- Robert c. Neuman, jr. Rozdział 13, Związki karbonylowe: ketony, aldehydy, kwasy karboksylowe. [PDF]. Zaczerpnięte z: chem.UCR.Edu
- Germán Fernández. (14 września 2009 r.). Nomenklatura Aldehydos. Zaczerpnięte z: Chemicicaorganica.internet
- T.W. Graham Solomons, Craight B. Fryhle. Chemia organiczna. (Wydanie dziesiąte, s. 729-731) Wiley Plus.
- Jerry March i William H. brązowy. (31 grudnia 2015 r.). Aldehyd. Zaczerpnięte z: Britannica.com
- Wikipedia. (2018). Aldehydes. Zaczerpnięte z: https: // in.Wikipedia.org/wiki/aldehyd
- Morrison, r. T. I Boyd, r. N. (1990). Edycja chemii organicznej. Redakcja Addison-Wesley Iberoamericana.
- Carey, f. DO. (2006). Chemia organiczna szósta edycja. MC Graw Hill Editorial.
- Mathews, rozdz. K., Van Holde, K. I. I ATRERN, K. G. (2002). Biochemia. Trzecia edycja. Redakcja Pearson Adisson Wesley.

