Concept Concept Agent, najsilniejsze, przykłady

- 3352
- 265
- Arkady Sawicki
A Środek redukujący Jest to substancja, która spełnia funkcję zmniejszania środka utleniającego w reakcji redukcji tlenku. Środki zmniejszające to dawcy elektronów z natury, zazwyczaj substancje na najniższych poziomach utleniania i z dużą ilością elektronów.
Istnieje reakcja chemiczna, w której zmieniają się stany utleniania atomów. Reakcje te obejmują uzupełniający proces redukcji i utleniania. W tych reakcjach jeden lub więcej elektronów jednej cząsteczki, atomu lub jonu są przenoszone na inną cząsteczkę, atom lub jon. To implikuje wytwarzanie reakcji redukcji tlenku.

Podczas procesu redukcji tlenku pierwiastek lub związek, który traci (lub dona) jego elektron (lub elektron), nazywa się środkiem redukującym, kontrastując z tym środkiem utleniającym, który jest receptorem elektronów. Mówi się następnie, że środki zmniejszające zmniejszają środek utleniający i że środek utleniający utlenia środek redukujący.
Najlepszymi lub najsilniejszymi czynnikami redukującymi to te, które mają największe radio atomowe; to znaczy mają większą odległość od jądra do elektronów, które otaczają to samo.
Środki zmniejszające są zwykle jony metalowe lub ujemne. Wśród typowych środków redukujących są kwas askorbinowy, siarka, wodór, żelazo, lit, magnez, mangan, potas, sód, witamina C, cynk, a nawet ekstrakt marchewkowy.
[TOC]
Co są agentami redukującymi?
Jak już powiedziano, środki zmniejszające są odpowiedzialne za zmniejszenie środka utleniającego, gdy zachodzi reakcja redukcji tlenku.
Prostą i typową reakcją reakcji redukcyjnej tlenku jest reakcja aerobowego oddychania komórkowego:
Może ci służyć: aluminiowy wodorek (ALH3): struktura, właściwości, użyciaC6H12ALBO6(s) + 6o2(g) → 6co2(g) + 6h2Lub (l)
W tym przypadku, gdzie glukoza (c6H12ALBO6) reaguje z tlenem (lub2), glukoza zachowuje się jako czynnik redukujący, aby dać elektrony tlenu - to znaczy jest utleniany - a tlen staje się środkiem utleniającym.
W chemii organicznej najlepsze środki redukujące są uważane za odczynniki, które zapewniają wodór (h2) do reakcji. W tej dziedzinie chemii reakcja redukcji odnosi się do dodania wodoru do cząsteczki, chociaż poprzednią definicję (reakcje redukcyjne tlenku również stosują.
Czynniki, które określają siłę środka redukującego
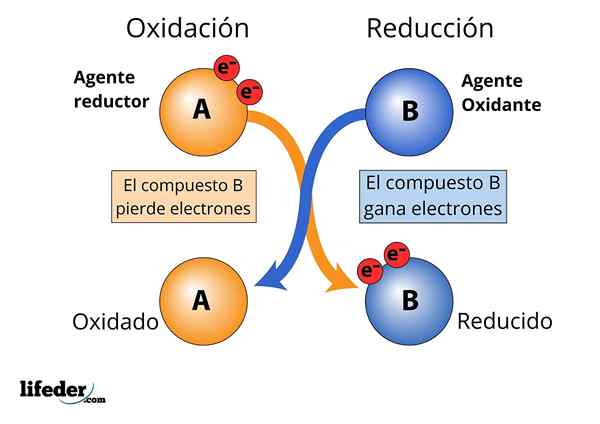 Utlenianie i zmniejszenie środka, obserwuje się utratę i wzmocnienie elektronów
Utlenianie i zmniejszenie środka, obserwuje się utratę i wzmocnienie elektronów Aby substancja była uważana za „silną”.
W tym celu istnieje wiele czynników, które należy wziąć pod uwagę, aby uznać siłę, jaką może mieć czynnik redukujący: elektroonegatywność, promień atomowy, energia jonizacji i potencjał redukcji.
Elektronialiczność
Electroneza jest właściwością opisującą tendencję atomu przyciągania kilku elektronów zjednoczonych w sobie. Im wyższa elektrooniczność, tym większa siła przyciągania wywierana przez atom wokół otaczających elektronów.
W stole okresowym elektrocjalność wzrasta od lewej do prawej, więc metale alkaliczne są najmniejszymi elementami elektroonegatywnymi.
Radio atomowe
To właściwość mierzy ilość atomów. Odnosi się do typowej lub średniej odległości środka jądra atomowego od granicy otaczającej go chmury elektronicznej.
Może ci służyć: azotyny: właściwości, struktura, nomenklatura, formacjaTa właściwość nie jest precyzyjna - a ponadto kilka sił elektromagnetycznych jest zaangażowanych w jej definicję - ale wiadomo, że wartość ta maleje od lewej do prawej w stole okresowym i rośnie od góry do dołu. Właśnie dlatego metale alkaliczne, zwłaszcza cezu, są uważane za większe radio atomowe.
Energia jonizacji
Ta właściwość jest definiowana jako energia wymagana do usunięcia mniej zjednoczonego elektronu z atomu (elektronu Valencia) w celu utworzenia kationu.
Mówi się, że im bliżej elektrony do jądra otaczającego atomu, tym większa energia jonizacji atomu.
Energia jonizacyjna wzrasta od lewej prawej i od dołu do góry w stole okresowym. Ponownie, metale (zwłaszcza alkaliczne) mają mniej energii jonizacji.
Potencjał redukcji
Jest to miara tendencji gatunku chemicznego do uzyskania elektronów, a zatem do zmniejszenia. Każdy gatunek ma wewnętrzny potencjał redukcji: im większy potencjał, tym większe powinowactwo z elektronami, a także jego zdolność do zmniejszenia.
Środki zmniejszające to substancje o mniejszym potencjale redukcji, ze względu na ich niewielkie powinowactwo do elektronów.
Silniejsze czynniki redukujące
W przypadku czynników opisanych powyżej można stwierdzić, że znalezienie „silnego” środka redukującego, atomu lub cząsteczki o niskiej elektroungatyczności, wysokim promieniu atomowym i niskiej energii jonizacji jest pożądana.
Jak już wspomniano, metale alkaliczne przedstawiają te cechy i są uważane za najsilniejsze środki redukujące.
Może ci służyć: węglowodory alifatyczne: właściwości, nomenklatura, reakcje, typyZ drugiej strony lit (Li) jest uważany za najsilniejszy środek redukujący jako najniższy potencjał redukcji, podczas gdy cząsteczka lialha4 Jest uważany za najsilniejszy czynnik redukujący ze wszystkich, ponieważ zawiera to i inne pożądane cechy.
Przykłady reakcji z czynnikami redukującymi
Istnieje wiele przypadków redukcji tlenku w życiu codziennym. Poniżej znajdują się niektóre z najbardziej reprezentatywnych:
Przykład 1
Reakcja spalania oktanu (główny składnik benzyny):
2 c8H18(l) + 25o2 → 16co2(g) + 18h2O (g)
Możesz zobaczyć, w jaki sposób oktan (środek redukujący) elektrony tlenu Dona (środek utleniający), tworzących dwutlenek węgla i wodę w dużych ilościach.
Przykład 2
Hydroliza glukozy jest kolejnym przydatnym przykładem powszechnej redukcji:
C6H12ALBO6 + 2adp + 2p + 2nad+ → 2ch3ORZECH KOKOSOWY2H + 2ATP + 2nadh
W tej reakcji cząsteczki NAD (receptor elektronów i środek utleniający w tej reakcji) przyjmują elektrony glukozy (środek redukujący).
Przykład 3
Wreszcie w reakcji tlenku żelaza
Wiara2ALBO3(s) + 2al (s) → do2ALBO3(s) + 2fe (l)
Środek redukujący to aluminium, podczas gdy środkiem utleniającym jest żelazo.
Bibliografia
- Wikipedia. (S.F.). Wikipedia. Uzyskane z in.Wikipedia.org
- BBC. (S.F.). BBC.współ.Wielka Brytania. Uzyskane z BBC.współ.Wielka Brytania
- Pearson, zm. (S.F.). Chemia librettexts. Uzyskane z Chem.Librettexts.org
- Badania, ur. (S.F.). Bodner Research Web. Uzyskane z Murmed.Chem.Purdue.Edu
- Peter Atkins, L. J. (2012). Zasady chemiczne: poszukiwanie wglądu.
- « Właściwości Cassia Angustifolia, przygotowanie, przeciwwskazania
- Charakterystyka projekcji azymutalnej, typy, zalety, wady »

