Emb
- 2435
- 455
- Herbert Wróblewski
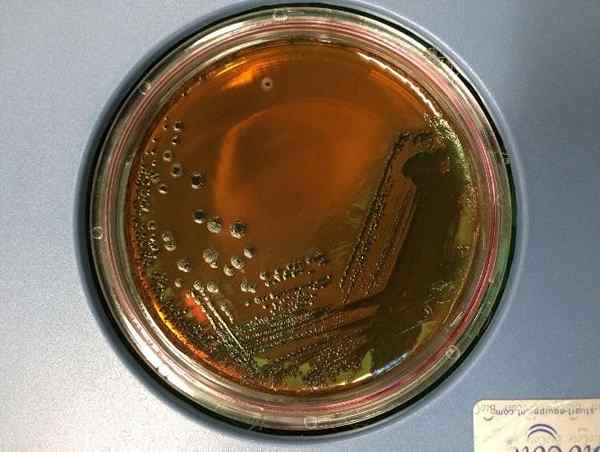
 E Lungerangular Pejście. Coli na Agar Emb. Źródło: Eunice Laurent, CC BY-SA 4.0, Wikimedia Commons
E Lungerangular Pejście. Coli na Agar Emb. Źródło: Eunice Laurent, CC BY-SA 4.0, Wikimedia Commons Co to jest Agar Emb?
On Emb Jest to selektywna i różnicowa pożywka hodowlana stała stosowana do izolacji bachilli Gram -ujemnych, głównie z rodziny Enterobacteriacee i innych nieudanych batamów Grama. Jest również znany z akronimu EAM, co oznacza eozinę-azul metylenu.
To medium zostało stworzone przez Holt-Harris i Teague w 1916 roku. Zawiera pepton, laktozę, sacharozę, fosforan dipotasowy, agar, eozynę, błękit metylenowy i wodę. Jest bardzo podobny do agaru MacConkey, zwłaszcza jeśli używany jest agar EMS według levine, który nie zawiera sacharozy.
W rzeczywistości każde laboratorium decyduje, czy działa z jednym lub drugim, ponieważ pełnią tę samą funkcję, chociaż biochemicznie są różne.
Przedstawia nawet takie same niedogodności jak klasyczny agar MacConkey w produkcji Swarming dla płci Odmieniec. Dlatego, aby uniknąć tego zjawiska, stężenie agaru można zwiększyć do 5%.
Podstawa
Selektywny
Agar EMP jest subtelnie selektywny, ponieważ zawiera kolorowanie anilinowe (eozyna i błękit metylenowy), które działają jako inhibitory, zapobiegając wzrostowi większości bakterii pozytywnych Grama i niektórych wymagających wymagających bachilli.
Jednak ten agar ma niedogodność, że niektóre bakterie dodatnie Gram mogą oprzeć się obecności substancji hamujących i rosnąć w tak małym punktufowaniu, takich jak pek Enterococcus faecalis a niektóre Staphylococcus.
Niektóre drożdże mogą również rosnąć, takie jak Kompleks Candida albicans, które da bardzo małe różowe kolonie. Clamidospor mogą nawet rozwinąć się z tego drożdży, jeśli próbka jest zasiana przez głębokość.
Mechanizm różnicowy
Z drugiej strony, agar Emb jest również pożywką różnicową, ponieważ te barwniki razem (eozyna i błękit metylenowy) mają właściwość tworzenia osadu w pH kwasu, dlatego służą one jako wskaźniki produkcji tego samego.
Może ci służyć: allometriaDlatego słabo fermentowanie lub bakterie sacharozy wytwarzają fioletowe kolory w ciągu 24 do 48 godzin. Na przykład gatunki Klebsiella, Enterobacter I Serratia.
Te bakterie, które silnie fermentują laktozę, takie jak Escherichia coli, lub sacharoza, jak Enterocolityczna yersinia albo Proteus Penneri, Tworzą zielonkawą czarną osad, dając wygląd metalicznej jasności, charakterystyczny u tych gatunków.
Należy zauważyć, że jeśli stosuje się pożywkę lewicową (bez sacharozy), Enterocolityczna yersinia I Proteus Penneri Będą produkować przezroczyste kolonie.
Bakterie, które nie fermentują laktozy lub sacharozy, są odżywiane przez obecność peptonas, które zapewniają aminokwasy i azot niezbędny do rozwoju bakterii i wytwarzają przezroczyste kolonie. Na przykład gatunki Salmonella I Shigella, pośród innych.
Ważne jest również podkreślenie, że płeć Acinetobacter Może przedstawić niebieskie kolonie lawendowe, nawet jeśli nie jest to laktoza fermeter lub sacharoza, ale mają właściwość ustalania błękitu metylenowego na ścianie komórkowej. Może się to również zdarzyć w przypadku innych bakterii oksydacyjnych.
Przygotowanie
Oryginalne odwodnione pożywkę to lekki beż. Aby przygotować tę pożywkę hodowlaną, 36 gramów odwodnionego pożywki należy ważić i zawieszać w poprawce, która zawiera litr wody destylowanej.
Po opuszczeniu mieszanki w spoczynku, zabierz Fixola do źródła ciepła, mieszając energiczny i stały sposób, aż się zagotuje i rozpuści się całkowicie.
Następnie już rozpuszczona pożywka hodowlana musi być sterylizowana za pomocą autoklawu w 121 ° C przez 15 minut.
Czas zakończony, jest usuwany z autoklawu i pozostawiaj krótko. Wtedy jest nadal gorąco (45-50 ° C) między 15 do 20 ml agaru na każdej sterylnej płycie Petriego. Medium musi być niebieskie lakmus.
Może ci służyć: AMILASE: Charakterystyka, klasyfikacja, struktura, funkcjePo podaniu płyty pozostają lekko odkryte, aż agar nieco się ochłodzi. Następnie są pokryte i pozwalają całkowicie zestalić. Następnie są one uporządkowane w odwróconych płytkach krwi i są przechowywane w lodówce (8 ° C).
Ta procedura jest najlepiej wykonywana w laminarnym dzwonku przepływowym lub przed zapalniczką Bunsena, aby zapobiec zanieczyszczeniu.
Ważne jest, aby pamiętać, że każdy dom komercyjny wskaże kwotę, którą należy zważyć, aby przygotować medium kultury.
Ostateczne pH medium musi wynosić 7.2 ± 0.2
Aplikacje
- Ta pożywka jest używana do zasiania moczu i kału lub dowolnego rodzaju próbek klinicznych, szczególnie jeśli podejrzewa się obecność nie -ujemnych bachilli Grama, takich jak bachilli należące do rodziny Enterobacteriaceae, która rośnie bardzo dobrze w tym pożywce.
- Bakterie enteropatogenne gatunków Shigella I Salmonella Wyróżniają się ich bezbarwnymi lub lekko bursztynowymi kolonami.
- Inne nieustanne bachilli rosną, takie jak Aeromonas, Pseudomonas, Acinetobacter, pośród innych.
- Ponadto to medium jest bardzo przydatne w analizie mikrobiologicznej żywności i wody, ponieważ idealnie nadaje się do całkowitej fazy potwierdzenia określenia coli, to znaczy potwierdzenie obecności I. coli Z mrocznych bulionów EC, z najbardziej prawdopodobnej techniki liczb (NMP).
QA
Aby sprawdzić, czy nowo przygotowane medium kultury działa dobrze, kontrole można zasiewać, aby zaobserwować cechy kolonii i sprawdzić, czy dają one zgodnie z oczekiwaniami.
Aby to zrobić, możesz użyć szczepów ATCC lub szczepów zidentyfikowanych dobrze I. coli, Enterobacter Aerogenes, Klebsiella sp, Salmonella Typhimurium, Shigella Flexneri, Pseudomonas aeruginosa i niektóre bakterie Gram -dodatnie, takie jak S. aureus.
Oczekuje się, że I. coli wygeneruj dobrze rozwinięte niebieskawe czarne kolonie z zielonym metalicznym połyskiem. Chwila Enterobacter Aerogenes I Klebsiella sp Muszą dać dobrze rozwinięte kolonie śluzowe niebieskawe czarne.
Może ci służyć: kolumna WinograskyZe swojej strony, Salmonella Typhimurium I Shigella Flexneri Muszą rozwijać duże, bezbarwne kolonie lub z lekkim bursztynowym kolorem.
Wreszcie gatunek Pseudomonas aeruginosa Rośnie jako bezbarwne kolonie o nieregularnej wielkości, podczas gdy bakterie dodatnie Gram powinny być całkowicie zahamowane lub dorastać z bardzo małymi kolonią.
Ostateczne rozważania
Czasami sterylizacja powoduje zmniejszenie błękitu metylenowego, obserwując pomarańczową pożywkę. Aby błękit metylenowy tlenek i odzyskał fioletowy kolor, należy go delikatnie mieszać, aż kolor się nie odbędzie.
Ponadto, po sterylizacji barwnik może wytrącić się, więc należy go dobrze zmieszać przed podaniem płytek Petriego.
Bibliografia
- Eozina i błękitny agar metylenowy. Odzyskane z Calab.com.
- Levine e.M.B. (Z eoziną i błękitem metylenowym). Odzyskane z Britanialab.com.

