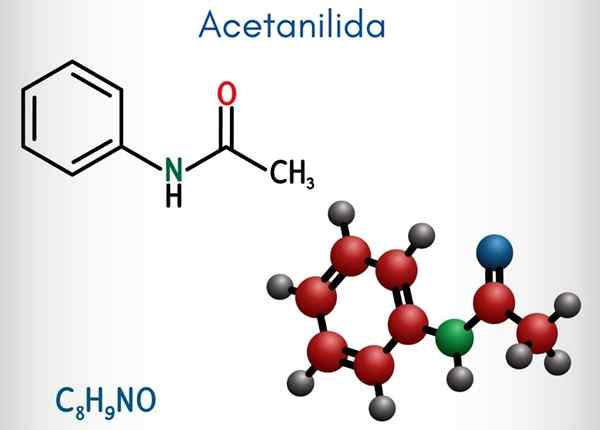
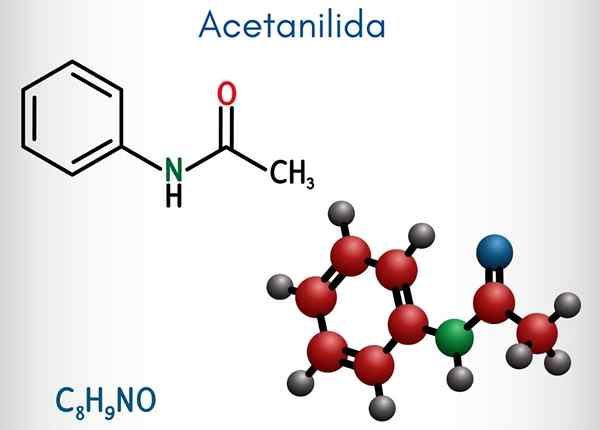
Acetanylide (C8H9NO)
- 3482
- 447
- Eliasz Dubiel
Co to jest acetanylid?
acetanylide (C8H9Nie) jest to aromatyczny amid, który otrzymuje kilka dodatkowych nazw: n-acetilarilamina, n-feenilacetamid i atetanil. Jest przedstawiony jako solidna toaleta w postaci płatków, jego chemiczny charakter to amida i jako taki może tworzyć łatwopalne gazy podczas reakcji z silnymi środkami redukującymi.
Ponadto jest to słaba baza, zdolność reakcji z czynnikami odwodniowymi, takimi jak P2ALBO5 Począć nitryl. Stwierdzono, że acetanyd miał działanie przeciwbólowe i antypirytyczne i został użyty w 1886. Cahn i str. Hepp.
W 1899 r. Na rynek wprowadzono kwas acetylosalicylowy (aspiryna), który miał takie same działania terapeutyczne jak acetanilid. Gdy stosowanie acetanylidu jest związane z pojawieniem się sinicy u pacjentów - konsekwencja metemoglobinemii indukowanej przez acetanylidu - jego zastosowanie zostało odrzucone.
Następnie ustalono, że działanie przeciwbólowe i antypieretyczne acetanylidu pochodziło z metabolitu tego tak zwanego paracetamolu (acetoaminofenu), który nie miał jego toksycznego efektu, jak sugerują Axelrod i Brodie.
Struktura chemiczna

Na górnym obrazie reprezentowana jest struktura chemiczna acetanylidu. Po prawej znajduje się sześciokątny aromatyczny pierścień benzenu (z liniami kropkowanymi), a lewica jest powodem, dla którego związek składa się z aromatycznej amidy: grupy acetamidowej (HNCOCH3).
Grupa acetamidu nadaje pierścieniu benzenu większy charakter polarny; To znaczy, stwórz moment dipolowy w cząsteczce atytanylidu.
Ponieważ? Ponieważ azot jest bardziej elektroonywalny niż którykolwiek z atomów węgla pierścienia i jest również powiązany z grupą acylową, której atom lub również przyciąga gęstość elektroniczną.
Może ci służyć: uretan: struktura, właściwości, uzyskiwanie, użyciaZ drugiej strony prawie cała struktura molekularna acetanylidu spoczywa na tej samej płaszczyźnie z powodu hybrydyzacji SP2 z atomów, które to komponują.
Istnieje wyjątek powiązany z tymi z grupy -ch3, którego atomy wodoru stanowią wierzchołki czworościanu (białe kule lewego końca opuszczają płaszczyznę).
Struktury rezonansowe i interakcje międzycząsteczkowe
Samotny moment obrotowy bez dzielenia się atomem n krąży przez układ π pierścienia aromatycznego, pochodząc z kilku struktur rezonansowych. Jednak jedna z tych struktur kończy się obciążeniem ujemnym w atomie O (więcej elektroungatywnych) i dodatnim obciążeniem w atomie n.
Zatem istnieją struktury rezonansowe, w których obciążenie ujemne porusza się w pierścieniu, a drugi tam, gdzie znajduje się w atomie lub. W wyniku tej „asymetrii elektronicznej”-która wynika z ręki asymetrii molekularnej-acetanyd oddziałuje międzycząsteczko przez siły dipol-dipolo.
Jednak interakcje mostów wodorowych (N-H-O-…) między dwiema cząsteczkami acetanylidu są w rzeczywistości dominującą siłą w jej strukturze krystalicznej.
W ten sposób kryształy acetanylidu składają się z ortorrbielicznych komórek jednostkowych ośmiu cząsteczek zorientowanych na formy „płaskich taśm” przez ich mosty wodorowe.
Powyższe można wizualizować, czy cząsteczka acetanylidu jest umieszczona na drugiej, równolegle. Tak jak grupy HNCOCH3 Nakładają się przestrzennie, tworzą mosty wodorowe.
Ponadto między tymi dwiema cząsteczkami można również „skradać” trzeci, ale z jego aromatycznym pierścieniem wskazującym na przeciwną stronę.
Może ci służyć: Bromotimol BlueWłaściwości chemiczne acetanylide
 Atrakcyjny wygląd
Atrakcyjny wygląd Waga molekularna
135 166 g/mol.
Opis chemiczny
Białe lub szarawe stałe. Tworzą jasne białe płatki lub krystaliczny biały proszek.
Zapach
Toaleta.
Smak
Lekko pikantne.
Punkt wrzenia
304 ° C do 760 mmHg (579 ° F przy 760 mmHg).
Temperatura topnienia
114,3 ° C (237,7 ºF).
Flash lub łatwopalność
169 ° C (337 ° F). Pomiar wykonany w otwartym szkle.
Gęstość
1 219 mg/ml w 15 ° C (1 219 mg/ml przy 59 ° F)
Gęstość pary
4.65 z relacją powietrzną.
Ciśnienie pary
1 mmHg przy 237 ° F, 1,22 × 10-3 mmHg w 25 ° C, 2A w 20 ° C.
Stabilność
Cierpia chemiczne z tyłu, gdy jest wystawione na światło ultrafioletowe. Jak zmienia się struktura? Grupa acetylowa tworzy nowe łącza w pierścieniu w pozycjach orto i dla. Ponadto jest stabilny w powietrzu i niezgodny z silnymi środkami utleniającymi, żądzami i alkaliami.
Zmienność
Znacznie niestabilne przy 95 ° C.
Samo -ukierunkowanie
1004 ° F.
Rozkład
Rozkłada się po podgrzaniu, emitując wysoce toksyczny dym.
Ph
5 - 7 (10 g/l H2Lub 25 ° C)
Rozpuszczalność
- W wodzie: 6,93 × 103 mg/ml w 25 ° C.
- 1 g Rozpuszczalność acetanylidu w różnych cieczych: w 3,4 ml alkoholu 20 ml wrzącej wody, 3 ml metanolu, 4 ml acetonu, 0,6 ml wrzącego alkoholu, 3,7 ml chloroformu, 5 ml gliecololu, 8 ml DiOxan, 47 ml benzenu i 18 eter. Hydrat chloral zwiększa rozpuszczalność acetanilidu w wodzie.
Synteza
Jest syntetyzowany przez reakcję bezwodnika octowego z acetanylidu. Ta reakcja pojawia się w wielu tekstach chemii organicznej (Vogel, 1959):
C6H5NH2 + (Ch3WSPÓŁ)2O => c6H5NHCOCH3 + Ch3Cooh
Może ci służyć: boraks: historia, struktura, właściwości, zastosowania, synteza, ryzykoAplikacje
- Jest to środek inhibitora procesu rozkładu nadtlenku wodoru (nadtlenek wodoru).
- Ustabilizować lakiery estru celulozowego.
- Interweniuje jako pośrednik w przyspieszeniu produkcji gumy. Podobnie jest pośrednikiem w syntezie niektórych barwników i kamfory.
- Działa jako prekursor syntezy penicyliny.
- Jest stosowany w produkcji chlorku 4-acetamidfonilbenzenu. Acetanylid reaguje z kwasem chlorosulfonowym (HSO3Cl), wytwarzając w ten sposób chlorek 4-aminosulfonilbenzen. Reaguje to z amonem lub pierwotną aminą organiczną z tworzeniem sulfonamidów.
- Został zastosowany eksperymentalnie w dziewiętnastym wieku w rozwoju fotografii.
- Acetanylid jest stosowany jako marker przepływów elektroosmotycznych (EOF) w elektroforezie kapilarnej do badania związku między lekami a białkami.
- Ostatnio 1- (Ω-fenoksyalkiluracylo) połączyło hamowanie w eksperymentach hamowania wirusa zapalenia wątroby typu C. Acetanylide łączy pozycję 3 pierścienia pirymidynowego.
- Wyniki eksperymentalne wskazują na zmniejszenie replikacji genomu wirusowego, niezależnie od genotypu wirusowego.
- Przed zidentyfikowaniem toksyczności acetanylidu zastosowano go jako przeciwbólowy i antypiretyczny od 1886 roku. Następnie (1891) zastosowano go w leczeniu przewlekłego i ostrego zapalenia oskrzeli przez Grün.