Tlenki niemetaliczne

- 3542
- 918
- Marianna Czarnecki
 Dwutlenek węgla jest gazem cieplarnianym, a także jest tlenek niemetaliczny
Dwutlenek węgla jest gazem cieplarnianym, a także jest tlenek niemetaliczny Co to są tlenki niemetaliczne?
Tlenki niemetaliczne Są to związki binarne utworzone między nie -metalowym ze stanem pozytywnym utlenianiem a tlenem ze stanem utleniania -2. Związki te nazywane również bezwodami i tlenkami kwasowymi mają tendencję do tworzenia roztworów kwasowych poprzez rozpuszczenie ich w wodzie, a także reagują z podstawowymi tlenkami, tworząc sole oksisal.
Tlenki nie -metaliczne są bardzo powszechne z natury. W rzeczywistości są wszędzie. Woda, żywotna ciecz, która obejmuje dwie trzecie powierzchni Ziemi, jest tlenek niemetaliczny. Podobnie jak dwutlenek węgla, który wydychamy podczas naszych oddychania i tlenków siarki, które zanieczyszczają powietrze i powodują kwaśne deszcz.
Powiązania, które łączą ich atomy, tworzone przez nie -metalowe i tlenowe (które również nie są. Z tego powodu zdecydowana większość tlenków nie metalowych lub anhydridowych ma znacznie niskie temperatury wrzenia, a wiele z nich to gazy w temperaturze pokojowej.
Właściwości tlenków niemetalicznych
- Nie mają połysku ani metalicznego połysku.
- Mogą mieć różne kolory.
- Ich atomy są zjednoczone za pomocą kowalencyjnych więzi zamiast linków jonowych.
- Są tworzone przez tlen i nie -metal.
- W porównaniu z tlenkami metali zwykle mają niskie temperatury topnienia i wrzenia, choć bardzo różnorodne.
- Większość to gazy, ale można je również znaleźć w stanie stałym (na przykład n2ALBO3) lub ciecz w temperaturze pokojowej.
- Solidne tlenki nie metalowe są zwykle kruche i mogą mieć inną twardość.
- Są złymi przewodami ciepła i prądu.
- Podczas rozpuszczania się w wodzie reagują na tworzenie kwasów oksydowych.
- Niektóre z jego kwasów oksydowych są silnymi kwasami, które mają tendencję do tworzenia anionów lub tlenów w roztworze wodnym.
- Reagują z podstawowymi tlenkami, tworząc sole oksisal.
Rodzaje nie -metalowych tlenków
Nie ma formalnej ani powszechnie akceptowanej klasyfikacji tlenków niemetalicznych. Można je jednak pogrupować zgodnie z ich właściwościami kwasowo-bazowymi.
Chociaż tlenki niemetaliczne są również nazywane tlenkami kwasowymi, nie wszystkie z nich zawsze reagują jako kwasy przeciwko innym związkom. W związku z tym trzy różne typy tlenków niemetalicznych można zidentyfikować zgodnie z ich właściwościami kwasu/podstawy:
Tlenki kwasu niemetalikowego
Są najczęstsze. Zdecydowana większość związków między tlenem a inną nie -metalową, niezależnie od ich stanu utleniania, wytwarza kwasy mineralne podczas rozpuszczenia w wodzie, powodując roztwory kwasowe.
- Niektóre przykłady tlenków kwasowych to bezwodnik azotowy (n2ALBO5) i bezwodnik siarkowy (więc3).
Neutralne nie -metalowe tlenki
Niektóre nie -metalowe tlenki w ogóle nie reagują z wodą podczas rozpuszczania się w niej. W takich przypadkach powstały roztwór jest neutralny (nie jest ani kwaśny, ani podstawowy).
- Niektóre przykłady neutralnych tlenków to tlenek węgla (CO), podtlenek azotu (N₂O) i dwutlenek chloru (CLO2).
Niemetaliczne tlenki amfotyczne
Termin Anfótero Odnosi się do zdolności związku chemicznego do zachowania się jako kwasu lub zasady, w zależności od tego, kto reaguje. Oznacza to, że są to związki, które są jednocześnie kwasami, jak i zasadami.
- Wśród amfotycznych tlenków niemetalicznych najczęstszą jest woda (h2ALBO). Woda jest amfotentna, ponieważ jest w stanie nadać protonowi podstawę (działającą jako kwas), ale jest również w stanie otrzymać proton kwasu (działający jako zasada).
Przykłady nie -metalowych tlenków
Najczęstsze nie -metalowe tlenki każdego nie -metalu przedstawiono poniżej, wraz z jego wzorem molekularnym, jego nazwa zgodnie z systematyczną nomenklaturą IUPAC, zgodnie z nomenklaturą i zgodnie z tradycyjną nomenklaturą:
Tlenki węglowe
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
WSPÓŁ | Tlenek węgla | Tlenek węglowy (ii) | Bezwodnik węglowy |
CO2 | Dwutlenek węgla | Tlenek węglowy (IV) | Bezwodnik węglowy |
Tlenki azotu
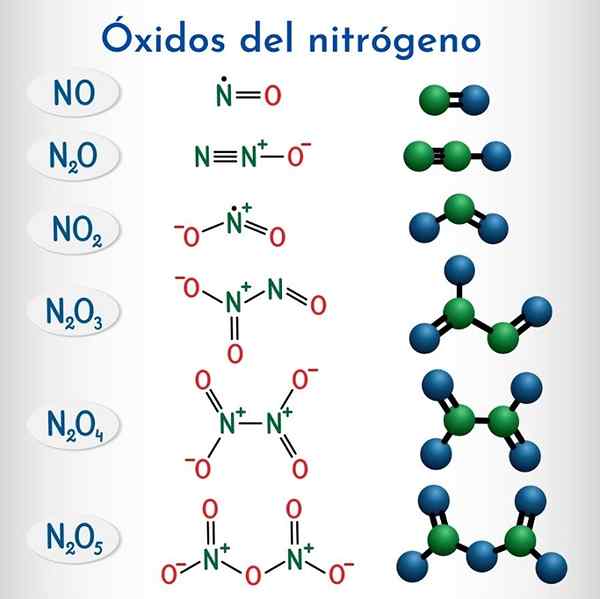 Wzory i struktury 6 niemetalicznych tlenków azotu
Wzory i struktury 6 niemetalicznych tlenków azotu Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
N2O | Tlenek monetitrogenu | Tlenek azotu (i) | Podtlenek azotu (Hiponitroso bezwodnik) |
NIE | Tlenek azotu | Tlenek azotu (ii) | Tlenek azotu |
N2O3 | TRIOTLENCEK DINITROGEN | Tlenek azotu (iii) | Azotnik bezwodnik |
N2O4 | Tetraksek dinitorowy | Tlenek azotu (IV) | Azot tetaksek |
NO2 | Dwutlenek azotu | Tlenek azotu (IV) | Dwutlenek azotu |
N2O5 | Pentaxide dintrogenu | Tlenek azotu (v) | Bezwodnik azotu |
Tlenki fosforu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
P2O3 | TRIOTLENCEKU DIPHOSFACKING | Tlenek fosforu (iii) | Bezwodnik fosforowy |
P2O5 | Pentaxide dyfosfack | Tlenek fosforu (v) | Bezwodek fosforowy |
P2O4 | Dyphosfack tetaksyd | Tlenek fosforu (III, v) | --- |
Tlenki arsenu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
AS2O3 | Trójtlenek dziennika | Tlenek arsenu (iii) | ARSENIOSO Bezwodnik |
AS2O5 | Pentaxide biegunkowe | Tlenek arsenowy (v) | Niedokręg arsenowy |
Tlenki antymonu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
SB2O3 | Diantimony TRIOTOLENIKE | Tlenek antymonu (iii) | Antymoniczny bezwknny |
SB2O5 | Diantimony Pentaxide | Tlenek antymonu (v) | Antymoniczny bezwodnik |
Tlenki siarki
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
południowy zachód | Tlenek monotenowy siarki | Tlenek siarki (ii) | Hiposulfurowy bezwknięcie |
SO2 | Dwutlenek siarki | Tlenek siarki (IV) | Bezwodnik siarki |
SO3 | TRIOTOLENSIDE SUARKI | Tlenek siarki (vi) | Bezwodnik siarkowy |
Tlenki selenu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
Seo | Tlenek selenu | Tlenek selenu (ii) | Hipplolenowy bezwodnik |
SEO2 | Dwutlenek selenu | Tlenek selenu (IV) | Bezwodnik selenowy |
SEO3 | TRIOROLOKED SELENIU | Tlenek selenu (vi) | Bezwodnik seléniczny |
Tlenki telurio
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
Teo | Tlenek monet telurio | Tlenek telurio (II) | Hipelurny bezwknny |
Teo2 | Dwutlenek telurio | Tlenek telurio (IV) | Teluszy bezwodnik |
Teo3 | TRIORIOKE TELURIO | Tlenek telurio (vi) | Teleryczny bezwodnik |
Tlenki chloru
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
CL2O | Tlenek chloru | Tlenek chloru (i) | Hipoklorysty bezwodnik |
CL2O3 | TRIOROKEK CHLOR | Tlenek chloru (iii) | Bezwodnik chloro |
CL2O5 | Pentaxide chloru | Tlenek chloru (v) | Bezwodnik chlorowy |
CL2O7 | Heptlenek chloru | Tlenek chloru (VII) | Bezwodnik nadchlorowy |
Tlenki bromu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
BR2O | Tlenek bromu | Tlenek bromu (i) | Hipobromowy bezwodnik |
BR2O3 | TRIOROLOKED BROMINY | Tlenek bromu (iii) | Bromowy bezwodnik |
BR2O5 | Pentaxide bromu | Tlenek bromu (v) | Bezwodnik bromowy |
BR2O7 | Heptaopsak bromowy | Tlenek bromu (VII) | Bezwodnik okołomowy |
Tlenki jodu
Formuła | IUPAC systematyczna nazwa | Nomenklatura zapasowa | Tradycyjna nazwa |
I2O | Tlenek jodu | Tlenek jodu (i) | Hypoyodoso bezwodnik |
I2O3 | TRIOROLOKED JODINE | Tlenek jodu (iii) | Bezwodnik z jodoso |
I2O5 | Pentalenek jodu | Tlenek jodu (v) | Bezwodnik Yodium |
I2O7 | Heptlenek jodu | Tlenek jodu (vii) | Bezwodnik periódicoic |

