Tlenek złota (III) (AU2O3) Co to jest, struktura, właściwości, używa
- 2441
- 489
- Pani Gilbert Stolarczyk
On Złoty tlenek (iii) Jest to związek nieorganiczny, którego wzorem chemicznym jest Au2ALBO3. Teoretycznie można oczekiwać jego natury poza typem kowalencyjnym. Jednak obecności pewnego charakteru jonowego w jego stałym nie można w pełni wykluczyć; lub co to samo, zakładaj brak katacji Au3+ obok anionu lub2-.
Może wydawać się sprzeczne, że złoto, będąc szlachetnym metalem, może utleniać. W normalnych warunkach złote kawałki nie mogą utleniać się przez kontakt z tlenem atmosfery; Jednak gdy są napromieniowane promieniowaniem ultrafioletowym w obecności ozonu, lub3, Panorama to kolejny.
Gdyby złote gwiazdy podlegały tym warunkom, stałyby się czerwonawo -brązowym kolorem, charakterystycznym dla AU2ALBO3.
Inne metody uzyskania tego tlenku oznaczałyby chemiczne obróbkę tych gwiazd; Na przykład przekształcenie ciasta złota w odpowiedni chlorek, aucl3.
Następnie do aucl3, A reszta możliwych utworzonych złotych soli dodaje się silny podstawowy medium; I dzięki temu uzyskuje się nawodniony lub wodorotlenek, au (OH)3. Wreszcie ten ostatni związek jest odwodniony termicznie w celu uzyskania Au2ALBO3.
Struktura tlenku złota (iii)
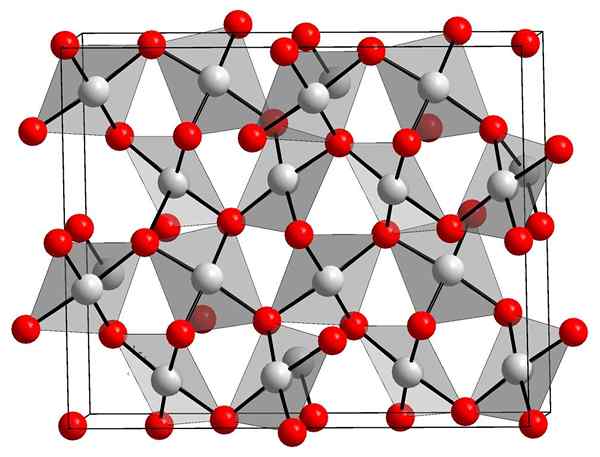
 Struktura krystaliczna tlenku złota. Orci, Wikimedia Commons.
Struktura krystaliczna tlenku złota. Orci, Wikimedia Commons. Górny obraz pokazuje krystaliczną strukturę złota (III). Pokazano rozmieszczenie atomów złota i tlenu w stałym, biorąc pod uwagę atomy neutralne (kowalencyjne stałe), albo jony (jonowe stałe). Zamiennie, po prostu wyeliminuj lub umieść linki AU-O w każdym przypadku.
Zgodnie z obrazem zakłada się, że dominuje znak kowalencyjny (który byłby logiczny). Z tego powodu pokazano odpowiednio atomy i linki reprezentowane z sferami i słupkami. Białe kule odpowiadają złotym atomom (auIii-O) i czerwone atomy tlenu.
Może ci służyć: hydroksyapatytJeśli zaobserwowano uważnie, okaże się, że istnieją jednostki AUO4, które wiążą się przez atomy tlenu. Innym sposobem wizualizacji byłoby rozważenie, że każda AU3+ jest otoczony czterema lub2-; Oczywiście z perspektywy jonowej.
Ta struktura jest krystaliczna, ponieważ atomy są uporządkowane przez posłuszność tego samego długiego wzoru. Zatem jego jednolita komórka odpowiada romboedralnej krystalicznej układu (tak samo jak górny obraz). Dlatego wszystkie au2ALBO3 Można go zbudować, gdyby wszystkie te kule komórki elementarnej były dystrybuowane w przestrzeni.
Aspekty elektroniczne
Złoto jest metalem przejściowym i oczekuje się, że jego orbitale 5D oddziałują bezpośrednio z orbitaliami 2p atomu tlenu. To nakładanie się orbitali teoretycznie musi generować pasma napędowe, co sprawiłoby, że AU2ALBO3 W półprzewodniku stałym.
Dlatego prawdziwa struktura Au2ALBO3 jest jeszcze bardziej złożone, mając to na uwadze.
Hydraty
Złoty tlenek może zachować cząsteczki wody w swoich kryształach romboedicanicznych, co powoduje hydracje. Kiedy takie hydraty powstają, struktura staje się amorficzna, to znaczy nieuporządkowane.
Wzór chemiczny dla takich hydratów może być dowolnym z poniższych, które w rzeczywistości nie są głęboko wyjaśnione: au2ALBO3∙ ZH2O (z = 1, 2, 3 itp.), Au (OH)3, lub auXALBOI(OH)z.
Formuła AU (OH)3 reprezentuje uproszczenie prawdziwego składu tych hydratów. Wynika to z faktu, że w ramach wodorotlenku złota (III) naukowcy odkryli również obecność Au2ALBO3; I dlatego traci sens traktowania go w izolacji jako „prosty” wodorotlenek metalu przejściowego.
Może ci służyć: równowaga płynówZ drugiej strony, stałego z formułą AuXALBOI(OH)z Można oczekiwać amorficznej struktury; ponieważ zależy to od współczynników X, I I z, którego zmiany spowodowałyby wszystkie rodzaje struktury, które z trudem wykazywaliby krystaliczny wzór.
Nieruchomości
Wygląd fizyczny
To czerwonawo -brązowy stał.
Masa cząsteczkowa
441,93 g/mol.
Gęstość
11,34 g/ml.
Temperatura topnienia
Topi się i rozkłada w 160ºC. Brakuje mu temperatury wrzenia, więc ten tlenek nigdy się nie gotuje.
Stabilność
Au2ALBO3 Jest to niestabilne termodynamicznie, ponieważ, jak wspomniano na początku, złoto nie ma tendencji do utleniania w normalnych warunkach temperaturowych. Aby łatwo było go zmniejszyć, aby stać się szlachetnym złotem.
Im wyższa temperatura, tym szybsza będzie ta reakcja, która jest znana jako rozkład termiczny. Zatem Au2ALBO3 W 160ºC rozkłada się, aby uzyskać metaliczne złoto i uwolnić tlen molekularny:
2 au2ALBO3 => 4 au + 3 o2
Bardzo podobna reakcja może wystąpić w przypadku innych związków, które sprzyjają tej redukcji. Dlaczego redukcja? Ponieważ złoto zyskuje elektrony, które usunął tlen; Co to samo, co utrata linków do tlenu.
Rozpuszczalność
Jest to nierozpuszczalna substancja stała w wodzie. Jest jednak rozpuszczalny w kwasie solnym i kwasie azotowym, ze względu na tworzenie się złotych chlorków i azotanów.
Nomenklatura
Złoty tlenek (III) to nazwa rządzona przez nomenklaturę zapasową. Inne sposoby, aby o tym wspomnieć, to:
-Tradycyjna nomenklatura: tlenek aury, ponieważ Valencia 3+ jest największym dla złota.
-Nomenklatura systematyczna: trójtlenek dioroczny.
Aplikacje
Kolorowanie szkła
Jednym z jego najbardziej znaczących zastosowań jest zapewnienie czerwonawego koloru niektórym materiałom, takim jak okulary, oprócz nadania niektórych właściwości związanych z atomami złota.
Może ci służyć: bromek wodoru (HBR)Synteza lotnisk i piorunującego złota
Jeśli AU zostanie dodane2ALBO3 Do pożywki, w którym jest rozpuszczalny, aw obecności metali może wytrącić po dodaniu silnej podstawy wodów; które są tworzone przez aniony auo4- W towarzystwie kationów metalowych.
Także Au2ALBO3 reaguje z amoniakiem, tworząc piortujący złoty związek, au2ALBO3(NH3)4. Jego imię wywodzi się z faktu, że jest wysoce wybuchowe.
Manipulacja monokapami samodzielna manipulacja monokapami
Na złocie i jego tlenku niektóre związki nie są adsorbowane w ten sam sposób, takie jak Diamilfur Diilil, RSSR. Gdy nastąpi ta adsorpcja, wiązanie Au-S jest tworzone spontanicznie, gdzie atom siarki wykazuje i definiuje charakterystykę chemiczną wspomnianej powierzchni w zależności od grupy funkcjonalnej, z którą jest połączone.
RSSR nie może być adsorbowany przez AU2ALBO3, Ale o metalicznym złoto. Dlatego jeśli powierzchnia złota i jego stopień utleniania są modyfikowane, a także wielkość cząstek lub warstw Au2ALBO3, Można zaprojektować bardziej heterogeniczną powierzchnię.
Ta powierzchnia au2ALBO3-AUSR oddziałuje z tlenkami metali niektórych urządzeń elektronicznych, rozwijając w ten sposób przyszłe mądrzejsze powierzchnie.
Bibliografia
- Złote tlenki. Odzyskane z: 911metalurgist.com
- Shi, r. Asahi i c. Stampfl. (2007). Właściwości złota tlenki au2ALBO3 i au2O: Badania pierwszych punktów. Amerykańskie społeczeństwo fizyczne.
- « ChigualCan Co to jest, cechy, siedlisko, zastosowania, właściwości
- Hemidesmosomy Co to jest, opis, struktura, funkcje »

