Tlenek litu
- 3189
- 645
- Maksymilian Kępa
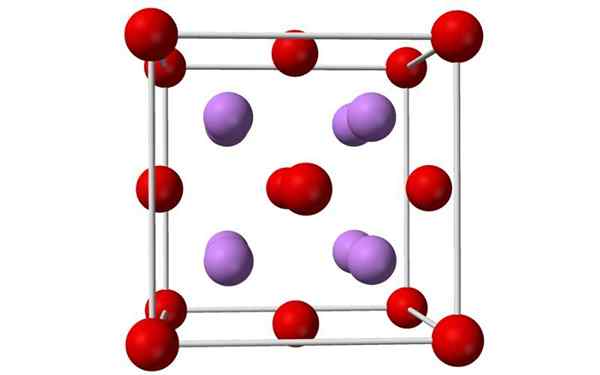
 Sfery i modelki jednolitej komórki tlenku litu. Źródło: Benjah-BMM27, Wikimedia Commons
Sfery i modelki jednolitej komórki tlenku litu. Źródło: Benjah-BMM27, Wikimedia Commons Co to jest tlenek litu?
On Tlenek litu Jest to nieorganiczny związek chemiczny o wzorze li2Lub to powstaje wraz z niewielkimi ilościami nadtlenku litu, gdy metal litowy jest spalany w powietrzu i łączy się z tlenem.
Do lat 90. rynek metalu i litu był zdominowany przez amerykańską produkcję z depozytów mineralnych, ale na początku XXI wieku większość produkcji pochodzi z innych źródeł: Australia, Chile i Portugalia były najważniejszymi dostawcami na świecie. Boliwia ma połowę złoża litu na świecie, ale nie jest to świetny producent.
Najważniejszą postacią komercyjną jest węglan litowy, Li2WSPÓŁ3, wyprodukowane z minerałów lub salmuelas przez kilka różnych procesów.
Kiedy lit płoną w powietrzu, głównym produktem jest biały tlenek litu, Li, Li2ALBO. Ponadto występuje niektóre nadtlenek litu, Li2ALBO2, Także biały.
Można to również wykonać poprzez rozkład termiczny wodorotlenku litowego, litowego lub nadtlenku litu, Li2ALBO2.
4li (s) + o2(g) → 2LI2Ty)
2lioh (s) + ciepło → Li2Lub (s) + h₂o (g)
2li2ALBO2(s) + ciepło → 2LI2Lub (s) + lub2(G)
Fizyczne i chemiczne właściwości
- Tlenek litu jest białą substancją stałą znaną jako litia, która nie ma aromatu i ma słony smak.
- Tlenek litowy to kryształy o geometrii przeciwblorynowej, podobne do chlorku sodu (sześcienne na twarz).
- Jego masa cząsteczkowa wynosi 29,88 g/mol, jego gęstość wynosi 2 013 g/ml, a temperatury fuzji i wrzenia wynoszą odpowiednio 1438 ° C i 2066 ° C.
Może ci służyć: EPID- Związek jest bardzo rozpuszczalny w wodzie, alkoholu, eterze, pirydynie i nitrobenzenie.
- Tlenek litowy łatwo reaguje z parą wodną, tworząc wodorotlenek i dwutlenek węgla z tworzeniem węglanu; Dlatego musi być przechowywany i zarządzany w czystej i suchej atmosferze.
- Związki tlenkowe nie prowadzą energii elektrycznej. Jednak niektóre strukturalne tlenki perowskity są przewodnictwem elektronicznym, które znajdują zastosowanie w katodzie ogniw paliwowych tlenku stałego i systemach wytwarzania tlenu.
- Są to związki, które zawierają co najmniej jeden anion tlenowy i metaliczny kation.
Ryzyko
Tlenek litu jest stabilnym związkiem niezgodnym z silnymi kwasami, wodą i dwutlenkiem węgla. O ile wiemy, właściwości chemiczne, fizyczne i toksykologiczne nie zostały zbadane i dokładnie zgłoszone.
Toksyczność związków litowych jest funkcją ich rozpuszczalności w wodzie. Jon litu ma toksyczność w ośrodkowym układzie nerwowym. Związek jest wysoce żrący, irytujący, jeśli wchodzi w kontakt z oczami i skórą.
W przypadku kontaktu wzrokowego musisz sprawdzić, czy soczewki kontaktowe są używane i natychmiast je usunąć. Należy je spłukać z bieżącą wodą przez co najmniej 15 minut, utrzymując otwarte powieki. Można użyć zimnej wody, a nie maści o oko.
Jeśli chemikalia zetknie się z ubraniami, zachowaj je tak szybko, jak to możliwe, chroniąc własne ręce i ciało. Umieść ofiarę pod prysznicem bezpieczeństwa.
Jeśli chemikalia gromadzi się w odsłoniętej skórze ofiary, takiej jak dłonie, skóra zanieczyszczona bieżącą wodą i mydłem niebrazowym jest delikatnie myte i ostrożnie. Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, szukaj pomocy medycznej. Umyj zanieczyszczone ubrania przed ponownym użyciem.
Może ci służyć: Skala Rankine: co to jest, konwersje, przykładyW przypadku inhalacji ofiara powinna mieć możliwość stania w dobrze wentylowanym obszarze. Jeśli inhalacja jest poważna, ofiara musi zostać jak najszybciej ewakuowana na bezpieczny obszar.
Poluzuj ciasne ubrania, takie jak szyje koszuli, pasy lub krawat. Jeśli ofiara jest trudna do oddychania, należy podać tlen. Jeśli ofiara nie oddycha, powstaje resuscytacja usta.
Zawsze biorąc pod uwagę, że może być niebezpieczne dla osoby, która zapewnia pomoc w resuscytacji usta, gdy wdychany materiał jest toksyczny, zaraźliwy lub żrący. We wszystkich przypadkach należy szukać natychmiastowej pomocy medycznej.
Aplikacje
- Tlenek litu jest stosowany jako założyciel emalii ceramicznych i tworzy niebieski z miedzią i różami z kobaltem. Reaguje z wodą i parą, tworząc wodorotlenek litu i powinien być od nich izolowany.
- Tlenek litu (Li2O), z jego wysokim potencjałem TRITIO, jest atrakcyjnym kandydatem do materiału uprawy stałego w zakładzie energii fuzyjnej DT, ze względu na jego wysoką gęstość atomów litowych (w porównaniu z innymi ceramikami litowymi lub metalicznymi) i jego względnie wysokiej przewodności termicznej przewodności termicznej.
Li2O Będzie narażony na wysokie temperatury pod napromieniowaniem neutronowym podczas działania koców fuzyjnych. W tych okolicznościach w Li zostanie wyprodukowana duża liczba wad napromieniania2Lub, takie jak obrzęk indukowany helą, stosunkowo wysoka ekspansja cieplna, wzrost ziarna, tworzenie lih (t) i opady w niskich temperaturach i transport masy lioh (t) w wysokich temperaturach.
Ponadto Li2Lub będą podlegać napięciom wynikającym z różnic rozszerzalności cieplnej między Li2O i materiały konstrukcyjne. Te cechy Li2Lub prowadzić do trudnych problemów inżynierskich zarówno w produkcji, jak i w projektowaniu Manta.
Może ci służyć: Wodorku strontu (SRH2)- Możliwe nowe zastosowanie jest jak zamiennik kobaltu i tlenku litu, taki jak katoda w akumulatorach litowych używanych do zwiększania elektronicznych urządzeń telefonu komórkowego do laptopów, a także samochodów z akumulatorami.
Bibliografia
- Elementy amerykańskie. Tlenek litu. Odzyskane z amerykańskich amerykańskich.com.
- Tlenek litu. Odzyskane z espimetals espimetals.com.
- Tlenek litu (LI2O). Ferp wyzdrowiał.UCSD.Edu ferp.UCSD.Edu.

