Właściwości tlenku chloru (v), struktura,

- 4834
- 268
- Prokul Woliński
On Tlenek chloru (v) Jest to wysoce niestabilny związek nieorganiczny, którego wzorem chemicznym jest Cl2ALBO5. Jest to jeden z wielu tlenków chloru, które charakteryzują się gatunkami molekularnymi, a nawet radykalnymi.
Cl2ALBO5 Znalazł życie tylko na papierze i obliczenia teoretyczne; Jednak jego istnienie nie zostało wykluczone i jest prawdopodobne, że niektóre można scharakteryzować (za pomocą zaawansowanych technik spektroskopii)))). Z powodu ogólnych pojęć chemii można przewidzieć tego tlenku, to to, że jest to bezwodnik kwasu chlorowego, HCLO3.
 Cząsteczka CL2O5. Źródło: Jynto [CC0].
Cząsteczka CL2O5. Źródło: Jynto [CC0]. Hipotetyczna cząsteczka tlenku chloru (V) pokazano powyżej (v). Zauważ, że ponieważ jest to cząsteczka, obecność Cl+5; Jeszcze mniej, gdy musi mieć tak polaryzującą moc, aby zmusić tlen, łącząc kowalencyjnie.
Jak każdy niestabilny związek, uwalnia energię do rozkładu w bardziej stabilnych produktach; proces, który w wielu przypadkach jest wybuchowy. Kiedy CL2ALBO5 Łamie wolność2 I2. Teoretyczne jest, że w wodzie, w zależności od izomeru Cl2ALBO5, Można utworzyć kilka chloru oksoacidów.
[TOC]
Nieruchomości
Masa molowa CL2ALBO5 to 150 9030 g/mol. Na podstawie tej masy i jej hipotetycznej cząsteczki można przypuszczać, że jeśli można ją wyizolować, prawdopodobnie byłby to ciecz tłustą; Oczywiście porównanie go z fizycznym wyglądem CL2ALBO7.
Chociaż nie można go izolować ani scharakteryzować, ten tlenek chloru jest kwaśny, kowalencyjny. Jego kwasowość jest zrozumiała, jeśli analizuje się równanie chemiczne jego hydrolizy:
Może ci służyć: prawo amagat: wyjaśnienie, przykłady, ćwiczeniaCl2ALBO5 + H2Lub 2HCLO3
Bycie HCLO3 Kwas chlorowy. Odwrotna reakcja spowodowałaby, że kwas można odwodnić:
2HCLO3 => Cl2ALBO5 + H2ALBO
Z drugiej strony, gdy CL2ALBO5 Jak tylko nastąpi, rozkłada się:
2cl2ALBO5 => 4clo2 + ALBO2
Jest to zatem gatunek pośrednik zamiast prawidłowego mówienia tlenku. Jego rozkład musi być tak szybki (biorąc pod uwagę, że CL jest nawet uformowane2ALBO5), których nie można było wykryć za pomocą obecnych technik analizy instrumentalnej.
Struktura tlenku chloru (V)
Cząsteczka
Na górnym obrazie pokazano strukturę hipotetycznej cząsteczki CL2ALBO5 Z modelem kulek i barów. Czerwone kule reprezentują atomy tlenu i zielone do chloru. Każdy chlor ma trygonalne środowisko piramidy, więc jego hybrydyzacja musi być sprzedna3.
Zatem cząsteczka CL2ALBO5 Można to postrzegać jako dwie trygonalne piramidy połączone tlenem. Ale jeśli zostanie dokładnie zaobserwowane, piramida prowadzi swoje atomy tlenu w dół, a druga poza płaszczyzną (w kierunku czytelnika).
Stąd zakłada się, że w linku są obroty lub2Cl-o-cl2, tworząc cząsteczkę stosunkowo dynamiczną. Zauważ, że formuła lub2Cloclo2 Jest to sposób na przedstawienie struktury CL2ALBO5.
Struktura Lewisa
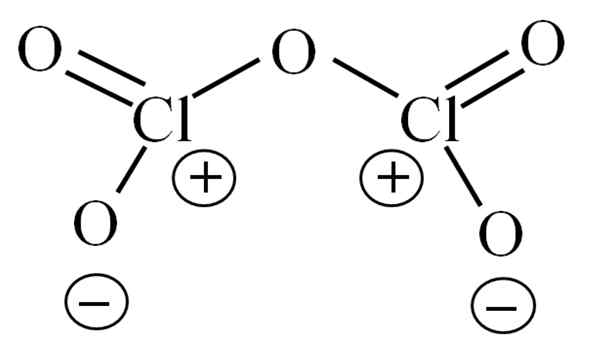 Struktura Lewisa dla hipotetycznego CL2O5. Źródło: Gabriel Bolívar.
Struktura Lewisa dla hipotetycznego CL2O5. Źródło: Gabriel Bolívar. Do tej pory sama cząsteczka nie pozwoliła na rozszyfrowanie tego, jaka jest jej niestabilność. Aby rzucić światło na to pytanie, jego struktura Lewisa jest używana, reprezentowana powyżej. Zauważ, że można błędnie myśleć, że konstrukcja jest płaska, ale w przedniej części podsekcji wyjaśniono, że tak nie jest.
Może ci służyć: azid sodu (NAN3): struktura, właściwości, zastosowania, ryzykoDlaczego oba atomy chloru mają dodatnie obciążenia formalne? Ponieważ chlor ma parę wolną od elektronów, które można zweryfikować, gdy zastosowana zostanie teoria łącza Valencia (co z powodu uproszczenia nie zostanie tutaj wykonane). Zatem jego formalne obciążenie wynosi:
CF = 7 - (4 + 2) = 1
A co to ma wspólnego z twoją niestabilnością? Cóż, chlor jest znacznie elektroonegatywny, a zatem jest złym nosicielem dodatnich obciążeń formalnych. To powraca do CL2ALBO5 Niezwykle kwaśny gatunek, ponieważ musi zdobyć elektrony, aby zaspokoić zapotrzebowanie elektroniczne dwóch chloros.
Wręcz przeciwnie do BR2ALBO5 I ja2ALBO5, tlenki, które istnieją w normalnych warunkach. Wynika to z faktu, że zarówno brom, jak i jod są mniej elektroonywacyjne niż chlor; I dlatego lepiej wspierają dodatnie obciążenie formalne.
Izomery i ich odpowiednia hydroliza
Jak dotąd całe wyjaśnienie spadło na jeden z dwóch izomerów CL2ALBO5: O2Cloclo2. Który jest drugim? O3Cloclo. W tym izomerze chloros nie ma dodatnich obciążeń formalnych, a zatem powinny być bardziej stabilną cząsteczką. Jednak zarówno OR2Cloclo2 jak O3Cloclo powinien ponieść reakcje hydrolizy:
ALBO2Cl-o-cl2 + H2O => 22Cl-oh (które są niczym więcej niż hclo3)
ALBO3Cl-O-clo + H2O => o3Cl-oh (Hclo4) + Ho-clo (hclo2)
Zauważ, że można utworzyć do trzech chloru oksoacidów: HCLO3, Hclo4 I Hclo2
Nomenklatura
Jego nazwa „Tlenek chloru (v)” odpowiada przypisanemu zgodnie z nomenklatury zapasowej. Cl2ALBO5 Może również mieć dwie inne nazwy: pentalenek bezwodnika Dicloro i Cloring, przypisany odpowiednio przez systematyczne i tradycyjne nomenklatury.
Może ci służyć: tytan: historia, struktura, właściwości, reakcje, zastosowaniaAplikacje
Bardziej niż motywowanie studiów komputerowych, CL2ALBO5 Nie będzie go używać, dopóki nie zostanie wykryte, odizolowane, scharakteryzowane, przechowywane i wykazało, że nie eksploduje do najmniejszego kontaktu.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Sandra Luján Quiroga i Luis José Perissinotti. (2011). Chloru oksoacidy i struktura tlenków dichloru. Chem. Pedagator, t. 16.
- Preparat chemiczny. (2019). Tlenek chloru (v). Odzyskane z: preparat quimica.com
- Linus Pauling. (1988). Chemia ogólna. Dover Publications, Inc., Nowy Jork.
- Richard c. Ropp. (2013). Encyklopedia związków Ziemi alkalicznej. Elsevier.
- « Neolamarckizm tło i charakterystyka
- Struktura wodorotlenku żelaza (ii) właściwości, zastosowania »

