Struktura wodorotlenku żelaza (ii) właściwości, zastosowania
- 3651
- 707
- Marianna Czarnecki
On wodorotlenek żelaza (ii), Nazywany również wodorotlenkiem żelaza, jest nieorganicznym związkiem o wzorze chemicznym wiary (OH)2. Jeśli jego czystość jest wysoka, jego stałe składa się tylko z jonów wiary2+ I och- W związku 2: 1; Jednak cząsteczki wody i różne gatunki jonowe mogą zawierać, zmieniając pozycję.
Reprezentuje „zredukowaną” formę słynnej rdzy, czerwonawej powierzchni złożonej z jonów wiary3+; Podczas pobytu w zielonkawej rdzy dominuje wiara2+, obok OH- i kolejna ilość anionów: co32-, południowy zachód42-, NIE3- i HaLuros (F-, Cl-,… ), Na przykład. Rezultatem, chociaż podstawą tej zielonej rdzy jest wiara (OH)2, jest to, że uzyskuje się różne ciała stałe.
 Zielony tlenek na powierzchni żelaza: materiał źródłowy tego rodzaju wodorotlenku. Źródło: Pixabay.
Zielony tlenek na powierzchni żelaza: materiał źródłowy tego rodzaju wodorotlenku. Źródło: Pixabay. W życiu codziennym wodorotlenek ten można rozważać w wspólnych miejscach. Na przykład górny statek obrazu ma swoją pokrytą powierzchnię zielonej rdzy (nie patyny). Jest wiara (oh)2, ale w towarzystwie licznych jonów z fal morza.
Chemicznie właściwości i zastosowania tego materiału zależą od kationu wiary2+ i jego tendencji do utleniania się do przekształcania się w wiarę3+. Jest to środek redukujący, który szybko reaguje z tlenem w podstawowych warunkach. Dlatego należy go stosować w obojętnej atmosferze i roztworach kwasowych.
[TOC]
Struktura wodorotlenku żelaza (ii)
Spinki do mankietów
Biorąc pod uwagę tylko wiarę (OH)2 Czysty, nie ma nic więcej jonów wiary2+ I och-.
Interakcje między nimi muszą być teoretycznie natury jonowej; Każda wiara wiary2+ przyciąga dwa aniony oh-, którego nie -kierunkowe atrakcje ustanawiają strukturalny i powtarzalny porządek definiujący kryształ; że z kolei powoduje powstanie zielonego kurzu rdzy.
Może ci służyć: wodorotlenek cynku (Zn (OH) 2)Problem polega na tym, że istnieje pewien charakter kowalencyjny między obiema jonami, a zatem jonowego łącza Fe-OH nie można zignorować. Biorąc pod uwagę częściowo jonowy łącze Fe-OH, można zrozumieć, że są one pogrupowane w rodzaj warstwy polimerowej.
Podwójne warstwy wodorotlenku
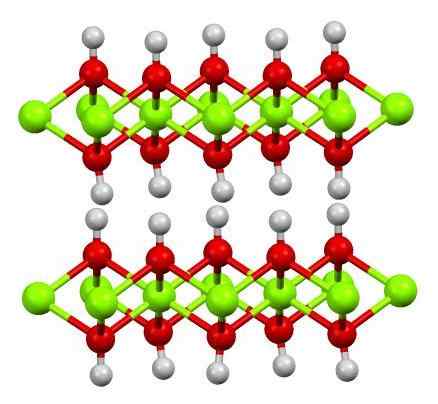
 Struktura wiary (OH) 2. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Struktura wiary (OH) 2. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Struktura czystego wodorotlenku żelaza z modelem kul i słupków pokazano powyżej. Katory Fe2+ Są reprezentowane przez zielone kulki chłodne, podczas gdy OH Aniony- Dla czerwonych i białych kul. Zwróć uwagę, w jaki sposób jony wiary są wyrównane2+ Dzięki interakcjom (joonicowo-warstwowym) z OH-.
Dlaczego ta struktura to podwójne warstwy wodorotlenków? Sam obraz zawiera odpowiedź: istnieją dwa rzędy lub warstwy OH- Dla każdej wiary2+; to znaczy proporcja 2: 1 wiary (OH) jest utrzymywana2 wspomniane na początku.
Jednostki strukturalne dla wiary (OH)2 Są to te kanapki, w których warstwy OH- Przybyli, by reprezentować bochenki; negatywnie załadowany chleb i dlatego nie naprawia uderzającego brązowego kryształu.
Ale z drugiej strony atomy H również łączą się i przyćmią ze sobą. Pamiętając o pojęciu polaryzacji i elektroungalizacji, hydrogeny mają niewielkie dodatnie obciążenie częściowe, δ+; które, choć słabe, mogą mieć pozytywny obszar, w którym znajdują się inne aniony lub cząsteczki.
Hydraty
Kiedy wiara (oh)2 Rozpuszcza się w wodzie, a jego cząsteczki koordynują z metalowym centrum wiary2+ Tworzyć złożone acu: [wiara (h2ALBO)4(OH)2]. Ten kompleks ma oktaedryczną geometrię do posiadania sześciu ligandów: czterech cząsteczek wody i dwóch OH-. Jednak w wodorotlenku żelaza panorama jest nieco inny.
Może ci służyć: prawo dotyczące ochrony materiiW hydracie, hipotetyczna wzór Fe (OH)2· NH2Lub cząsteczki wody są umieszczone dokładnie między dwiema warstwami wodorotlenku; Oznacza to, że oddziałują one przez siły dipol-jonowe z białymi hydrogenami lub kulami. To tak, jakby złapano dwa mecze OHFEOH, a woda była przeplatana, aby je grupować: Ohfeoh (h (h2O) OHFEAH.
Cząsteczki wody są bardzo dynamiczne, uniemożliwiając uzyskiwanie cząstek hydratu znaczne rozmiar.
Zielona i czerwona rdza
W hydratach warstwy wodorotlenkowe mają przeplatane cząsteczki wody; Mogą jednak mieć inne aniony (już wspomniane), powodując szeroką gamę zielonych Herrbles. Mogą również „złapać” cząsteczki tak duże jak DNA lub leki.
Jony wiary mogą być obecne nie tylko2+, ale także wiara3+, produkt wewnętrznego utleniania spowodowany przez przeplatany tlen. Widocznie zaobserwowano, że zielona rdza (tlenek U) zaczyna stać się czerwonawe wraz ze wzrostem stężenia wiary3+.
Nieruchomości
 Rurka testowa z wodorotlenkiem żelaza w wodzie. Źródło: Chemicalinterest [domena publiczna]
Rurka testowa z wodorotlenkiem żelaza w wodzie. Źródło: Chemicalinterest [domena publiczna] Wiara (OH) pokazano powyżej2 wytrąć w rurze testowej. Będąc w obfitej wodzie, złożony ACU musi dominować powyżej nowo wymienionej struktury. Zauważ, że powierzchnia wygląda jak kolor pomarańczowy, w wyniku utleniania wiary2+ do wiary3+ dla tlenu powietrza; Oznacza to, że ten wodorotlenek jest czynnikiem redukującym:
Wiara2+ Wiara3+ + I-
Fizycznym wyglądem tego związku w najczystszym stanie to brązowa substancja substancji stałej:
 Czysty wodorotlenek żelaza. Źródło: Ondřej Mang [domena publiczna]
Czysty wodorotlenek żelaza. Źródło: Ondřej Mang [domena publiczna] Który, w zależności od poziomu wilgotności, można przedstawić jako galaretki stałe. Jest dość nierozpuszczalny w wodzie (ksp= 8 · 10-16 i rozpuszczalność = 0,72 g/100 ml w 25ºC) i ma masę molową 89,86 g/mol i gęstość 3,4 g/ml.
Może ci służyć: 20 rodzajów chemii i ich deni udzielaniaNie zgłaszano żadnego punktu gotowania lub fuzji dla tego związku; Prawdopodobnie ze względu na fakt, że przed źródłem ciepła staje się on odwodniony i przekształca się w tlenek żelaza, brzydki:
Wiara (OH)2 => Ugly + H2ALBO
Aplikacje
Organiczna analiza jakościowa
Jego moc redukująca służy do określenia obecności związków nitro, RNO2. Reakcja, dla której uzyskuje się test dodatni, jest reprezentowany z następującym równaniem chemicznym:
RNO2 + 6fe (OH)2 + 4h2O => rnh2 + 6fe (OH)3
Wiara (OH)3 wytrąca się jako brązowy stał stały, który certyfikuje obecność grupy nitro, -no2.
Reduktor oxoanions selenium
Moc redukująca wiarę (OH)2 Używał również do zmniejszenia anionów SEO32- (Selenito) i SEO42- (selenian) do podstawowego selenu,. Praktycznie pozwala na usunięcie takich anionów, szkodliwe dla zdrowia, w postaci nierozpuszczalnego i łatwo zdejmowanego selenu stałego.
Materiały do podwójnych warstw
Jego czysta struktura i zielona rdza jest źródłem inspiracji do projektowania nowych materiałów o cechach mineralogicznych.
Szacuje się, że ich funkcją pozwala na transport określonego gatunku między jego warstwami, w taki sposób, że jego wyzwolenie można kontrolować lub zredukować do miejsca aktywnego (gleby, komórki, powierzchnia metalu itp.).
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Żelazo (ii) wodorotlenek. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Wodorotlenek żelaza. Baza danych Pubchem. CID = 10129897. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Nick Doe. (S.F.). Testy fenoli i grup nitro. Chemia 211. Źródło: akademicki.Wellesley.Edu
- Clark Jim. (27 kwietnia 2019). Chemia żelaza. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Oprogramowanie techniczne Kingston. (2019). Chemia rdzy. Lekarze korozji. Odzyskane z: krosno korozji.org
- Zingaro, Ralph A. i in. (1997). Zmniejszenie anionów oksoselenów przez wodorotlenek żelaza (II). Środowisko międzynarodowe. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Właściwości tlenku chloru (v), struktura,
- Właściwości tlenku chloru (iii), struktura, zastosowania »

