Właściwości tlenku chloru (iii), struktura, zastosowania
- 4405
- 1179
- Pani Waleria Marek
On tlenek chloru (iii) Jest to związek nieorganiczny, którego wzorem chemicznym jest Cl2ALBO3. Odpowiada bezwodnikowi kwasu chlorowego, HCLO2. Jest to ciemnobrązowy stał, wysoce wybuchowy nawet w temperaturach poniżej 0ºC i źle scharakteryzowany. Dlatego podlega zainteresowaniu studiami komputerowymi.
Chemicznie jest to kowalencyjny tlenek, więc istnieją wiązania Cl-O i dyskretna cząsteczka Cl2ALBO3 (niższy obraz). Ta cząsteczka może tworzyć odwodnienie HCLO2, lub przez poddanie się niskim temperaturom. Szczegółem jest to, że rozkłada się produkcji CL2, ALBO2, lub inne termodynamicznie bardziej stabilne tlenki chloru.
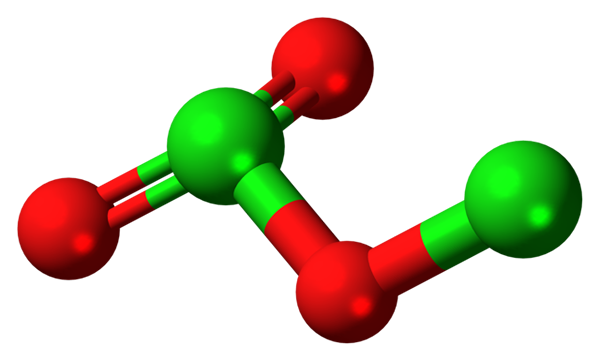
 Cząsteczka trójtlenku Dicloro. Źródło: Jynto [CC0].
Cząsteczka trójtlenku Dicloro. Źródło: Jynto [CC0]. Ponieważ obligacje CL-O są małe polarne, e-mail CL2ALBO3 Ma mały moment dipolowy; Dlatego nie rozpuszcza się dobrze w wodzie ani nie oddziałuje z innymi rozpuszczalnikami polarnymi. Jego niestabilność jest taka, że nie jest znane zastosowania komercyjne ani potencjalne (lub jako wybuch możliwość zastosowania byłaby realna).
Głównym powodem jego niestabilności może być elektroniczne cechy domniemanego CL3+ (Zakładanie charakteru czysto jonowego). W rzeczywistości jego utlenianie +1 i +5 są najbardziej stabilne, gdy chlor tworzy związki z tlenem.
[TOC]
Nieruchomości
Ponieważ jego charakterystyka jest słaba i nie udokumentowana, nie ma wiele do powiedzenia na temat jego właściwości, z wyjątkiem następujących punktów:
-Ma masę cząsteczkową 118 903.
-Jest to solidny ciemnobrązowy; Chociaż możesz sublimizować chlor gazowy, mówiąc żółtawo -zielone opary.
-Brakuje mu zarówno punktu gotowania, jak i fuzji, ponieważ w 0ºC eksploduje (i w chłodniejszych temperaturach).
Może ci służyć: fosforan dihydroksyacetonu (DHAP): Charakterystyka i zastosowania-Jego rozpuszczalność w wodzie szacuje się na około 3,42 g/100 ml, co dowodzi, że jest to kowalencyjna cząsteczka o niskiej polarności.
-Reaguje z wodą (małą, która się rozpuszcza), aby stać się HCLO2:
Cl2ALBO3 + H2Lub 2HCLO2
Struktura tlenku chloru (III)
Na obrazie pokazano strukturę molekularną CL2ALBO3 Z modelem kulek i barów. Chociaż nie wydaje się to nagim okiem, milczące implikacje ich powiązań i ustaleń przestrzennych są bardziej skomplikowane niż się wydaje. Ta struktura odpowiada jednemu z wielu możliwych izomerów dla tego związku.
Czerwone kule odpowiadają atomom tlenu i zielonymi atomami chloru. Chlor po lewej przedstawia trygonalną geometrię piramidy, z kilkoma wolnymi elektronami; Można więc założyć, że twoja hybrydyzacja musi być sprzedna3. Atom tlenu działa jak most między dwoma chlorami, Cl-O-CL.
Izomery
Jakie są inne izomery? Teoretycznie obliczane są dziewięć, z których cztery są najbardziej stabilne (w tym obraz). Pozostałe trzy miałyby takie struktury, jak:
-Clclo3. Bardzo podobny do wyjaśnionego, ale z linkiem CL-CL.
-CLOOOOCL (1). W tym izomerze znajduje się most trzech tlenu, który oddziela dwa atomy chloru (pamiętaj o geometrii kątowej H2Lub do wizualizacji).
-CLOOOCL (2). Ten sam utleniony most jest również obecny w tym izomerze, z wyjątkiem dwóch atomów chloru są przyćmione w przestrzeni; jeden przed drugim, podczas gdy w poprzednim izomerze są odległe.
Może ci służyć: AlquinosNomenklatura
Jego nazwa, tlenek chloru (III), odpowiada przypisanemu według nomenklatury zapasowej. Tutaj zakłada się, że chlor ma stan utleniania +3; Ale nie oznacza to, że kation CL3+ może być obecny. Jest to cząsteczka, a nie sieć jonowa.
Inna nazwa, pod którą znany jest również CL2ALBO3 Według systematycznej nomenklatury jest to trójtlenek dicloro.
I finał. Ta nazwa wynika z faktu, że, jak już wyjaśniono, CL2ALBO3 Występuje, gdy HCLO2 To skrapla wodę wodą.
Aplikacje
Ponieważ jest to tlenek chloru, najbardziej natychmiastowe zastosowanie, które można pomyśleć dla CL2ALBO3 Jest jak środek utleniający, zdolny do neutralizowania zanieczyszczeń organicznych i drobnoustrojów. Jest jednak bardzo niestabilny, oprócz materiałów wybuchowych, więc w tym celu jest uważane za przydatne.
Na pewno nie ma informacji, nawet jak CL by się zachowywał2ALBO3 pod ogromnym presją (jeśli nie eksploduje w trakcie procesu). W normalnych warunkach wydaje się być niczym więcej niż stosunkowo stabilnym i różnicowym pośrednikiem wśród innych bardziej stabilnych tlenków chloru.
Jednak obliczeniowo badanie było określenie mechanizmów wolnych rodników, które obejmują kilka gatunków chloru i tlenu.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Dichlor trójtlenku. Źródło: w:.Wikipedia.org
- Daj mu l. Wino z gruszek. (2011). Podręcznik związków nieorganicznych. (Druga edycja). CRC Press Taylor & Francis Group.
- Richard c. Ropp. (2013). Encyklopedia związków Ziemi alkalicznej. Elsevier.
- Kim k. H., Han i.K., i czytaj i. S. (1999). Bazowe wpływ na stabilność izomerów Cl2O3 przy użyciu metod B3P86 i B3LYP teorii funkcjonalnej gęstości. Journal of Molecular Structure Theochem 460 (1-3): 19-25.
- « Struktura wodorotlenku żelaza (ii) właściwości, zastosowania
- Struktura tetrodotoksyny, charakterystyka, zastosowania, efekty »

