Tlenek siarki
- 2643
- 503
- Herbert Wróblewski
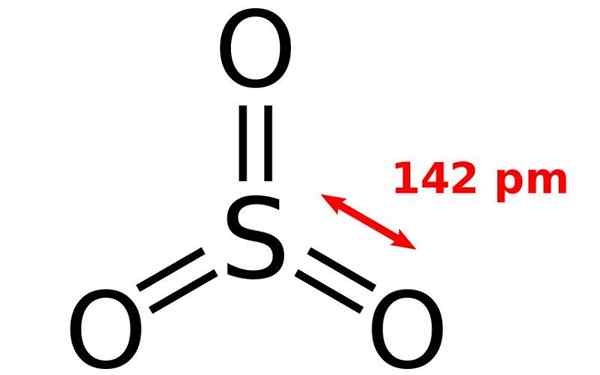
 Struktura chemiczna cząsteczki tlenku siarki. Źródło: Joel Holdsworth, Wikimedia Commons
Struktura chemiczna cząsteczki tlenku siarki. Źródło: Joel Holdsworth, Wikimedia Commons Co to jest tlenek siarki?
On Tlenek siarki (Vi), znane również jako triorek bezwodnika siarki lub siarki, jest chemicznym związkiem o wzorze S3, Że w normalnych warunkach jest to bezbarwne i włókniste stałe, a w 25 ° C i 1 atm jest potężnym środkiem zanieczyszczającym, odpowiedzialnym za kwaśny deszcz.
TRIOTLENEKID SULFURY jest wytwarzany przez utlenianie utleniacza siarki.
Jednak do tej pory jedyne preparat z czystym trójtlekiem siarki z gazów zawierających3 rozcieńczony był procesem w skali pilotażowej, która implikuje kondensację krioskopową.
Zamiast zwykłej procedury oznacza, że destylacja olejowa. Ciepło wymagane do destylacji oleju jest dostarczane wygodniej przez gazowy gaz z powiązanej rośliny kwasu siarkowego.
Można go przygotować w laboratorium poprzez podgrzanie palenia kwasu siarkowego i zbieranie sublimowanego w chłodzonym odbiorniku. Jeśli para jest skondensowana powyżej 27 ° C, kształt gamma jest uzyskiwany jako ciecz.
Jeśli para jest skondensowana poniżej 27 ° C i w obecności linii wilgotności, uzyskuje się mieszaninę trzech form. 3 formy można oddzielić przez destylację ułamkową.
Spalanie paliw kopalnych jest przyczyną jego wyglądu w atmosferze, jest to główna przyczyna antropogeniczna.
Właściwości fizyczne i chemiczne tlenku siarki
- Triutled siarki ma kształt białych igieł, które stają się dymem w powietrzu. Często napotykasz inhibitory, aby uniknąć polimeryzacji.
Może ci służyć: renio: odkrycie, właściwości, struktura, zastosowania- Jego masa cząsteczkowa wynosi 80 066 g/mol, jego gęstość wynosi 1,92 g/cm³ g/ml, a temperatury fuzji i wrzenia wynoszą odpowiednio 16,8 ° C i 44,7 ° C.
- Związek łączy się z wodą o sile wybuchowej, tworząc kwas siarkowy ze względu na jego kwasowość. Substancje organiczne TRIOROKU SULFURY CARBONIZA.
- Trójtlenek siarki szybko pochłania wilgoć, emitując gęste białe opary. Roztwory trójtlenku kwasu siarkowego nazywane są paleniem kwasu siarkowego lub oleju.
- Reakcja trójtlenku siarki i diffluorek.
- Nadmiar reakcji trójtlenku siarki z tetrafluoroetylenem powoduje rozkład wybuchowy fluoru karbonylowego i dwutlenku siarki.
- Reakcja bezwodnego kwasu nadchlorowego z trójtlenkiem siarki jest gwałtowna i towarzyszy ewolucja znacznego ciepła. Ciekła siarka triorek reaguje gwałtownie chlorkiem nitrylowym, nawet 75 ° C.
- Reakcja trójtlenku siarki i tlenek ołowiu powodują białą luminescencję. Połączenie jodu, pirydyny, siarki i trójtlenku formamidu rozwinęło gaz po ciśnieniu po kilku miesiącach.
Wynika to z powolnego tworzenia kwasu siarkowego, wody zewnętrznej lub odwodnienia formamidu cyjankowego.
Ryzyko
Tri -tlenku siarki jest stabilnym związkiem, niezgodnym z materiałami organicznymi, drobno sproszkowanymi metaliami, zasadami, wodą, cyjankami i szeroką gamą innych chemikaliów.
Substancja jest silnym utleniaczem i gwałtownie reaguje z materiałami palnymi i organizatorami oraz związkami organicznymi, które powodują niebezpieczeństwo ognia i wybuchu.
Może ci służyć: szczawian sodu (Na2C2O4): struktura, właściwości, zastosowania, ryzykoReaguje gwałtownie z mokrą wodą i powietrzem w celu wytworzenia kwasu siarkowego. Roztwór w wodzie jest silnym kwasem, reaguje gwałtownie z zasadami i metali żrących, tworząc łatwopalny / wybuchowy gaz.
Związek jest żrący dla metali i tkanek. Powoduje oparzenia w oczach i skórze. Spożycie powoduje ciężkie oparzenia w jamie ustnej, przełyku i żołądku. Para jest bardzo toksyczna przez wdychanie.
W przypadku kontaktu wzrokowego musisz sprawdzić, czy soczewki kontaktowe są używane i natychmiast je usunąć. Oczy należy spłukać z bieżącą wodą przez co najmniej 15 minut, utrzymując otwartą powieki. Można użyć zimnej wody bez nakładania maści oko.
Jeśli chemikalia zetknie się z ubraniami, zachowaj je tak szybko, jak to możliwe, chroniąc własne ręce i ciało. Umieść ofiarę pod prysznicem bezpieczeństwa.
Jeśli chemikalia gromadzi się w odsłoniętej skórze ofiary, takiej jak dłonie, skóra zanieczyszczona bieżącą wodą i mydłem niebrazowym jest delikatnie myte i ostrożnie. Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, szukaj pomocy medycznej. Umyj zanieczyszczone ubrania przed ponownym użyciem.
W przypadku inhalacji ofiara powinna mieć możliwość stania w dobrze wentylowanym obszarze. Jeśli inhalacja jest poważna, ofiara musi zostać jak najszybciej ewakuowana na bezpieczny obszar. Luźne ciasne ubrania, takie jak szyja koszulka, pasy lub krawat.
Jeśli ofiara jest trudna do oddychania, należy podać tlen. Jeśli ofiara nie oddycha, powstaje resuscytacja usta. Zawsze biorąc pod uwagę, że może być niebezpieczne dla osoby, która zapewnia pomoc w resuscytacji usta, gdy wdychany materiał jest toksyczny, zaraźliwy lub żrący.
Może ci służyć: kwas przysadki (H3PO2): właściwości, zastosowania i odczynnikiWe wszystkich przypadkach należy szukać natychmiastowej pomocy medycznej.
Z drugiej strony zanieczyszczenie powietrza spowodowane tlenkami siarki jest ważnym problemem środowiskowym, z milionami ton dwutlenku siarki i tritlesu na atmosferę każdego roku. Związki te są szkodliwe dla życia roślin i zwierząt, a także dla wielu materiałów budowlanych.
Kolejnym dużym problemem do rozważenia jest kwaśny deszcz. Oba tlenki siarki rozpuszczają się w atmosferycznych kroplach wodnych, tworząc roztwory kwasowe, co może być bardzo szkodliwe, gdy spadają w postaci deszczu.
Kwasowy deszcz może uszkodzić lasy i powodować śmierć ryb w wielu jeziorach. Jest również żrący dla metali, wapienia i innych materiałów. Możliwe rozwiązania tego problemu są drogie ze względu na trudność wyeliminowania siarki węgla i oleju przed spaleniem.
Aplikacje
- TRIOTLENEKID SULFURY jest niezbędnym odczynnikiem w reakcjach sulfonacji. Procesy te zapewniają detergenty, barwniki i produkty farmaceutyczne. Jest generowany in situ z kwasu siarkowego lub stosowany jako palenie roztworu kwasu siarkowego.
- Jego właściwości dezynfekujące są odpowiedzialne przez wieki do dezynfekcji kostek wina, spalanie w nich siarki.
Bibliografia
- Siarka trójtlenku. Odzyskane z EBI.AC.Wielka Brytania
- Bezpieczeństwo Sulphur TRIOTLEYKE SURFUR. Odzyskany z Sciencelab.com

