Historia wolframu, właściwości, struktura, użycia

- 4746
- 227
- Paweł Malinowski
On wolfram, Wolframio lub volframium to ciężki metal przejściowy, którego symbol chemiczny to w. Znajduje się w okresie 6 z grupą 6 tabeli okresowej, a jej liczba atomowa wynosi 74. Jego imię ma dwa znaczenia etymologiczne: piankę twardego kamienia i wilka; Po drugie dlatego, że ten metal jest również znany jako Wolframio.
Jest to srebrny szary metal i nawet jeśli jest kruchy, ma wielką twardość, gęstość i wysokie punkty fuzji i wrzenia. Dlatego zastosowano go we wszystkich tych zastosowaniach, które obejmują wysokie temperatury, ciśnienia lub siły mechaniczne, takie jak ćwiczenia, pociski lub włókna emitujące promieniowanie.
 Bar wolframowy z częściowo utlenioną powierzchnią. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Bar wolframowy z częściowo utlenioną powierzchnią. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Najbardziej znane zastosowanie tego metalu, na poziomie popularnym, znajduje się w włóknach żarówek elektrycznych. Kto ich zmanipulował, zda sobie sprawę, jak kruche są; Nie są one jednak wykonane z czystego wolframu, który jest plastyczny i plastyczny. Ponadto w macierzach metali, takich jak stopy, zapewnia doskonałą opór i twardość.
Charakteryzuje się i wyróżnia się byciem metalem o najwyższym punkcie fuzji, a ponieważ jest również gęstszy niż ten sam ołów, przewyższony tylko przez inne metale, takie jak osm i irydium. Jest to również najcięższy metal, o którym wiadomo, że spełnia biologiczną rolę w ciele.
W większości swoich związków jonowych anion wolframowy uczestniczy, wo42-, które mogą polimeryzować w celu spowodowania klastrów w kwaśnej pożywce. Z drugiej strony, wolfram może tworzyć związki międzymetaliczne lub steryzować za pomocą metali lub soli nieorganicznych, dzięki.
Nie jest to bardzo obfite w korze Ziemi, mając jako tonę zaledwie 1,5 grama tego metalu. Ponadto, ponieważ jest to ciężki element, jego pochodzenie jest międzygalaktyczne; W szczególności wybuchy supernowań, które musiały wrzucić „dysz” atomów wolframu na naszą planetę podczas ich formacji.
[TOC]
Historia
Etymologia
Historia wolframu lub Wolframio ma dwie twarze, a także ich nazwiska: jeden szwajcarski i drugi niemiecki. W 1600 roku, w regionach zajmowanych obecnie przez Niemcy i Austrię, górnicy pracowali nad ekstrakcjami miedzi i cyny w celu produkcji brązów.
Do tego czasu górnicy spotkali ciernia: istniał niezwykle trudny minerał; Mineral składał się z Wolframite, (wiara, Mn, Mg) wo4, które zachowały lub „pożerały” puszkę, jakby to był wilk.
Stąd etymologia tego elementu, „wilk” wilka po hiszpańsku, wilk, który zjadł puszkę; oraz „Ram” pianki lub kremu, którego kryształy przypominały długą czarne futro. Tak było tak, że nazwa „Wolfram” lub „Wolframio” pojawiła się na cześć tych pierwszych obserwacji.
W 1758 r4, Został nazwany „Tung Sten”, co oznacza „twardy kamień”.
Obie nazwiska, Wolframio i Tungsten, są powszechnie używane zamiennie, w zależności od kultury. Na przykład w Hiszpanii i na Europejskim Zachodzie metal ten jest znany bardziej przez Wolframio; podczas pobytu na kontynencie amerykańskim dominuje nazwa Tungsten.
Rozpoznawanie i odkrycie
Wówczas wiadomo, że między siedemnastym a osiemnastym wiekiem były dwa minerały: Wolframit i Scheelita. Ale kto zobaczył, że istnieje inny metal niż inne? Można je scharakteryzować tylko jako minerały, aw 1779 r.
Może ci służyć: kwas okołokromowy (HBRO4): właściwości, ryzyko i zastosowaniaPo stronie szwajcarskiej znowu Carl Wilhelm Scheele w 1781 r. Był w stanie odizolować wolfram3; A nawet więcej, uzyskał kwas tumatyczny (lub wolframiczny), h2Wo4 i inne związki.
Nie było to jednak wystarczające, aby dotrzeć do czystego metalu, ponieważ konieczne było zmniejszenie tego kwasu; to znaczy, poddawaj go takim procesowi, który nie będzie w stanie tlenu i krystalij jako metal. Carl Wilhelm Scheele nie miał odpowiedniej metodologii tej reakcji redukcji chemicznej.
To tutaj hiszpańscy bracia d'Luyar, Fausto i Juan José, którzy zredukowali oba minerały (Wolframite i Scheelita) z węglem, w mieście Bergara, w mieście Bergara. Dwa są przyznawane zasługą i zaszczytem bycia odkrywcami Wolframium lub metalicznego wolframu (W).
Stale i żarówki
 Każda żarówka z włóknem wolframowym. Źródło: Pxhere.
Każda żarówka z włóknem wolframowym. Źródło: Pxhere. Podobnie jak inne metale, jego zastosowania definiują jego historię. Wśród najbardziej widocznych do końca XIX wieku były stopy stalowe-tungsten i włókna wolframowe, aby zastąpić węgiel w żarówkach elektrycznych. Można powiedzieć, że pierwsze żarówki, jak wiemy, zostały sprzedawane w latach 1903–1904.
Nieruchomości
Wygląd fizyczny
To srebrny i błyszczący szary metal. Kruche, ale o wielkiej twardości (nie mylące z wytrwałością). Jeśli kawałek jest o dużej czystości, staje się on plastyczny i twardy, zarówno lub więcej stali.
Liczba atomowa
74.
Masa cząsteczkowa
183,85 g/mol.
Temperatura topnienia
3422ºC.
Punkt wrzenia
5930ºC.
Gęstość
19,3 g/ml.
Fusion Heat
52,31 kJ/mol.
Ciepło parowe
774 kJ/mol.
Molowa pojemność cieplna
24,27 kJ/mol.
MOH Twardość
7.5.
Elektronialiczność
2,36 na skali Pauling.
Radio atomowe
139 PM
Rezystancja
52.8 nω · m w 20ºC.
Izotopy
Przedstawia głównie w naturze jako pięć izotopów: 182W, 183W, 184W, 186W i 180W. Zgodnie z masą molową 183 g/mol, która średnio masy atomowe tych izotopów (i pozostałe trzydzieści radioizotopy), każdy atom wolframu lub wolframium ma około stu dziesięciu neutronów (74 + 110 = 184).
Chemia
Jest wysoce odporny na metal korozji, ponieważ jego cienka warstwa WO3 chroni go przed atakiem tlenu, kwasu i alkaliów. Po rozpuszczeniu i wytrącaniu się z innymi odczynnikami uzyskuje się ich sole, które nazywane są wolframaty lub wolfram; W nich wolfram ma stan utleniania +6 (zakładając, że istnieją kationów w6+).
Grupowanie kwasu
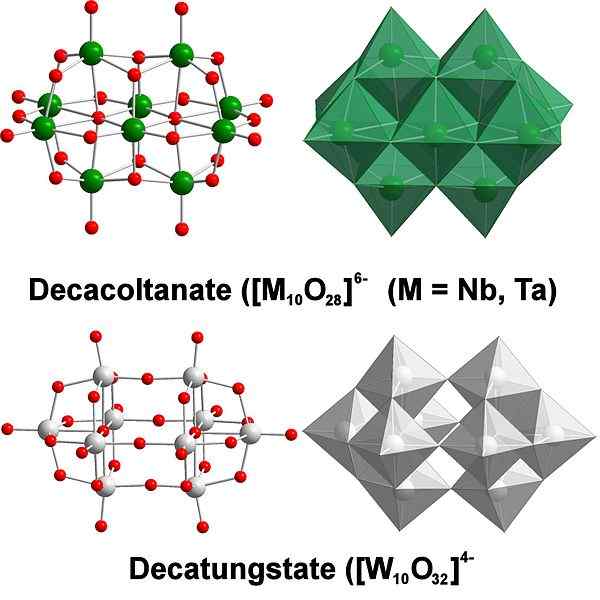 Decatungstate, przykład poliaksometalanów wolframowych. Źródło: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Decatungstate, przykład poliaksometalanów wolframowych. Źródło: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Chemicznie wolfram jest dość szczególny, ponieważ jego jony zwykle są grupowane (grupowanie w języku angielskim), tworząc heteropolicydy lub poliaksometalat. Czym oni są? Są to grupy lub klastry atomów, które wiążą się w celu zdefiniowania trójwymiarowego ciała; głównie jeden z sferyczną strukturą klatki, w której „otacza” inny atom.
Wszystko zaczyna się od anionu wolframu, wo42-, Które w kwaśnej pożywce jest protonowane (hwo4-) i powiązane z sąsiednim anionem do tworzenia [w2ALBO7(OH)2]2-; A to z kolei dołącza do innego [w2ALBO7(OH)2]2- Zrodzić [w4ALBO12(OH)4]4-. Tak, aż do roztworu jest kilka politugstanów.
Może ci służyć: chlorek litowy (LICL): właściwości, ryzyko i zastosowaniaParathungstate a i b, [w7ALBO24]6- i H2W12ALBO4210-, odpowiednio, są one jednym z najbardziej wybitnych z tych poliad.
Rozważenie jego szkicu i Lewisa może być wyzwaniem; Ale w zasadzie wystarczy je wizualizować jako sety Wo Octahedra6 (obraz górny).
Zauważ, że te szarawe oktahedry ostatecznie definiują DecatungState, Politungstate; Jeśli heteroátomo blokuje się w środku (na przykład fosfor), byłby to poliaksometalat.
Struktura elektroniczna i konfiguracja
Fazy krystaliczne
Atomy wolframu definiują strukturę sześcienną wyśrodkowaną z ciałem (BCC, przez Sześcienne). Ta krystaliczna postać jest znana jako faza α; Podczas gdy faza β jest również sześcienna, ale trochę gęsta. Zarówno fazy, jak i postacie krystaliczne, α i β, mogą współistnieć w równowadze w normalnych warunkach.
Ziarna krystaliczne fazy α są izometryczne, podczas gdy z fazy β przypomina kolumny. Niezależnie od tego, jak jest szkło, w tym rządzie. W przeciwnym razie nie można było wyjaśnić wysokich punktów topnienia i wrzenia ani wysokiej twardości i gęstości wolframu.
Metal Link
Atomy wolframu w jakiś sposób muszą być bardzo zjednoczone. Aby podnieść hipotezę, należy wcześniej zaobserwować konfigurację elektroniczną tego metalu:
[Xe] 4f145 d46s2
5D orbitale są bardzo duże i niewyraźne, co oznaczałoby, że między dwoma bliskimi atomami w są skuteczne nakładanie się orbity. Również orbitale 6s przyczynia się do powstałych pasm, ale w mniejszym stopniu. Podczas gdy orbitale 4F mają „bardzo głęboko”, a ich wkład w metalowy łącze jest niższy.
To, wielkość atomów i krystaliczne ziarna, są zmiennymi, które określają twardość wolframu i jego gęstość.
Stany utleniania
W wolframu lub metalicznym wolframium atomy w mają stan zerowego utleniania (w0). Powrót do konfiguracji elektronicznej orbitale 5D i 6s mogą „puste” elektrony w zależności od tego, czy W znajduje się w towarzystwie atomów bardzo elektrowni, takich jak tlen lub fluor.
Kiedy dwa elektrony 6s zostaną utracone, wolfram ma stan utleniania +2 (w2+), Co generuje jej umowę o atomie.
Jeśli stracisz również wszystkie elektrony swoich orbitali 5D, twój stan utleniania stanie się +6 (w6+); Stąd nie może stać się bardziej pozytywny (teoretycznie), ponieważ orbitale 4F dla bycia wewnętrznym wymagałyby wielkich energii, aby usunąć ich elektrony. To znaczy, że najbardziej pozytywny stan utleniania to +6, gdzie wolfram ma jeszcze niewielki.
Ten wolfram (VI) jest bardzo stabilny w warunkach kwaśnych lub w wielu związkach natlenianych lub ukochanych. Inne pozytywne i możliwe stany utleniania to: +1, +2, +3, +4, +5 i +6.
Tungsten może również zyskać elektrony, jeśli jest w połączeniu z mniejszymi atomami elektroungatywnymi niż on. W tym przypadku ich atomy stają się większe. Może zyskać maksymalnie cztery elektron; to znaczy stan utleniania -4 (w4-).
Uzyskanie
Wcześniej wspomniano, że wolfram jest znaleziony w minerałach Wolframite i Scheelita. W zależności od procesu uzyskano z nich dwa związki: tlenek wolframu, WO3, lub paratungstate amonowe (NH4)10(H2W12ALBO42) · 4H2O (lub ATP). Każdy z nich można zredukować do metalicznego w węglem powyżej 1050ºC.
Może ci służyć: prawo raault: zasada i formuła, przykłady, ćwiczeniaTo nie jest opłacalne ekonomicznie. Dlatego preferowane jest wytwarzanie go w postaci pyłu, aby kiedyś radzić sobie z innymi metali, aby uzyskać stopy.
Warto wspomnieć, że świat Chin jest krajem z największą produkcją wolframu. A na kontynencie amerykańskim, Kanadzie, Boliwii i Brazylii zajmują także listę największych producentów tego metalu.
Aplikacje
 Związek z węglika wolframowy: przykład, w jaki sposób twardość tego metalu można wykorzystać do unieśmiertelnienia i stwardnieniem materiałów. Źródło: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Związek z węglika wolframowy: przykład, w jaki sposób twardość tego metalu można wykorzystać do unieśmiertelnienia i stwardnieniem materiałów. Źródło: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Niektóre z znanych zastosowań tego metalu są wspomniane poniżej:
-Jego sole były używane do kolorowania bawełny starego stroju.
-W połączeniu ze stalą stwardniał jeszcze bardziej, nawet będąc w stanie oprzeć się mechanicznym cięciom przy dużych prędkościach.
-Włókna spiekania wolframu jest używane od ponad stu lat w żarówkach elektrycznych i lampie flogenerowanych. Ponadto, ze względu na wysoką temperaturę topnienia, służył jako materiał do rur katodowych i dysz w silnikach rakietowych.
-Zastępuje ołów w produkcji pocisków i tarcz radioaktywnych.
-Nanokabety wolframowe mogą być stosowane w nanodispozytywnym pH.
-Katalizatory wolframu wykorzystano do radzenia sobie z produkcją siarki w przemyśle naftowym.
-Węglenie wolframowe pochodzi ze wszystkich jego związków, które obejmują więcej zastosowań. Od wzmocnienia cięć i narzędzi wiertniczych lub produkcji wojskowych elementów uzbrojenia, po mechanizację drewna, tworzyw sztucznych i ceramiki.
Ryzyko i środki ostrożności
Biologiczny
Będąc stosunkowo rzadkim metalem w skórce Ziemi, jego negatywne skutki są rzadkie. W kwaśnych glebach politugstaty mogą nie wpływać na enzymy stosowane przez molibdyty; Ale w podstawowych glebach WO42- Interweniuje (pozytywnie lub negatywnie) w procesach metabolicznych MOO42- i miedź.
Na przykład rośliny mogą wchłonąć rozpuszczalne związki wolframu, a jedząc je zwierzę, a następnie po spożywaniu mięsa, atomy wchodzą w nasze organizmy. Większość jest wydalana w moczu i odchodach, a niewiele wiadomo, co dzieje się z resztą.
Badania na zwierzętach wykazały, że gdy wysokie stężenie proszku wolframu rozwijają objawy podobne do raka płuc.
Przez spożycie dorosły człowiek musiałby pić tysiące galonów wody wzbogaconych soli wolframu, aby wykazać znaczące zahamowanie enzymów kolinesterazy i fosfatazy.
Fizyczny
Ogólnie rzecz biorąc, wolframowy jest nieco toksycznym elementem, a zatem istnieje niewiele ryzyka gospodarza dla szkód zdrowotnych.
Jeśli chodzi o metaliczny wolfram, należy unikać oddychania jego pyłu; A jeśli próbka jest solidna, należy ją wziąć pod uwagę, że jest bardzo gęsta i może powodować uszkodzenie fizyczne, jeśli spadnie lub uderzy w inne powierzchnie.
Bibliografia
- Bell Terence. (S.F.). Tungsten (Wolfram): właściwości, produkcja, aplikacje i stopy. Równowaga. Odzyskane z: balita.com
- Wikipedia. (2019). Wolfram. Źródło: w:.Wikipedia.org
- Lentech b.V. (2019). Wolfram. Odzyskane z: lentech.com
- Jeff Desjardins. (1 maja 2017 r.). Historia wolframu, najsilniejszy naturalny metal na ziemi. Odzyskane od: VisualCapitalist.com
- Doug Stewart. (2019). Fakty elementów wolframowych. Odzyskane z: Chemicool.com
- Art Fisher i Pam Powell. (S.F.). Wolfram. University of Nevada. Odzyskane z: unce.R.Edu
- Helmestine, Anne Marie, pH.D. (2 marca 2019 r.). Fakty wolframu lub Wolfram. Odzyskane z: Thoughtco.com

