Charakterystyka, struktura, funkcje i testy troponiny
- 4262
- 1123
- Gabriela Łuczak
Troponina Jest to nazwa, która odbiera białko obecne w mięśniach szkieletowych i sercowych kręgowców, związanych z włókienami we włóknach mięśniowych i które ma funkcje w regulacji aktywności skurczowej (skurcz i rozluźnienie mięśni).
Włókna mięśniowe są komórkami tworzącymi tkankę mięśniową, której pojemność skurczu opiera się na interakcji między filamentami, które są zamawiane i ściśle powiązane w środku, zajmując większość objętości cytoplazmatycznej.
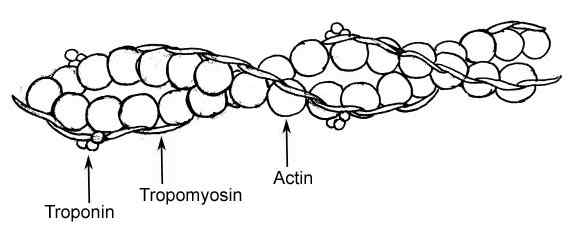 Graficzna reprezentacja elementów cienkiego włókna we włóknach mięśniowych (źródło: RAUL654, przez Wikimedia Commons)
Graficzna reprezentacja elementów cienkiego włókna we włóknach mięśniowych (źródło: RAUL654, przez Wikimedia Commons) Te włókna są znane jako miofilamenty i istnieją dwie klasy: grubość i cienka. Grube włókna składają się z cząsteczek miozyny II, podczas gdy cienkie włókna są kulisowymi polimerami aktyny lub aktyny w połączeniu z dwoma innymi białkami.
Zarówno aktyna, jak i miozyna znajdują się również w innych komórkach ludzkiego ciała i innych organizmów, tylko w znacznie mniejszych proporcjach i uczestniczących w różnych procesach, takich jak migracja komórek, egzocytoza, w cytokinezy (podczas podziału komórek), a nawet w wewnątrzkomórkowym ruchu pęcherzowym.
Troponina i tropomiozyna to dwa białka związane z cienkimi włóknami aktyny, które uczestniczą w regulacji procesów skurczu i relaksacji miofibryli komórek mięśniowych lub włókien.
Mechanizmy działania, przez które te dwa białka wykonują ich funkcję, są związane z wewnątrzkomórkowym stężeniem wapnia. System regulacji troponiny jest jednym z najbardziej znanych systemów w fizjologii i biochemii skurczu mięśni szkieletowych.
Te białka mają ogromne znaczenie dla organizmu. Obecnie wiadomo na pewno, że niektóre rodzinne lub wrodzone kardiomiopatie są produktem mutacji w sekwencji genów, które kodują dla (troponin lub tropomiozyna).
[TOC]
Charakterystyka
Troponina jest związana z aktyną cienkich włókien włókien mięśniowych w mięśniach szkieletowych i sercowych w stosunku stechiometrycznym od 1 do 7, to znaczy cząsteczki troponiny na każde 7 cząsteczek aktyny.
Białko to, jak podkreślają, występuje wyłącznie w włóknach zawartych wewnątrz miofibryli szkieletowych i sercowych włókien mięśniowych, a nie we włóknach mięśni gładkich, które tworzą mięśnie naczyniowe i trzewne.
Jest to wymyślone przez niektórych autorów, takich jak białko regulacyjne tropomiozyny. W ten sposób ma miejsca związkowe do interakcji z cząsteczkami aktyny, co daje mu zdolność do regulacji interakcji z miozyną grubych włókien.
Może ci służyć: aldohexosa: struktura molekularna i przykładyW miofilamentach związek między cząsteczkami troponiny i tropomiozyny wynosi od 1 do 1, co oznacza, że dla każdego istniejącego kompleksu troponiny istnieje cząsteczka tropomiozyny związana z tym z tym.
Struktura
Troponina jest kompleksem białkowym złożonym z trzech różnych kulistych podjednostek znanych jako troponina I, troponina C i troponina T, które razem sumują się, mniej więcej 78 kDa.
W ludzkim ciele znajdują się warianty specyficzne dla tkanek dla każdej z tych podjednostek, które różnią się od siebie na poziomie genetycznym i molekularnym (w odniesieniu do genów, które je kodują), jak na poziomie strukturalnym (w odniesieniu do ich aminokwasów sekwencje).
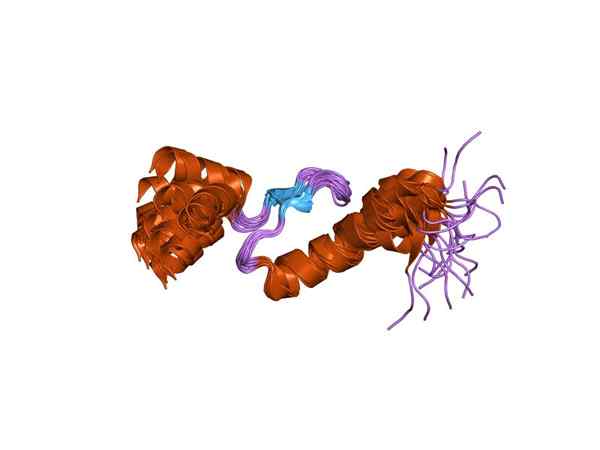
 Reprezentacja jednej z podjednostek troponiny (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons)
Reprezentacja jednej z podjednostek troponiny (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) Toponina C lub TNC jest najmniejszym z trzech podjednostek i być może jedną z najważniejszych. Ma 18 kDa masę cząsteczkową i ma miejsca do dołączenia wapnia (CA2+).
T lub TNT troponina jest tą, która ma miejsca związkowe do zakotwiczenia kompleksu trzech podjednostek do tropomiozyny i ma 30 kDa masę cząsteczkową; Jest również znany jako połączenie t -subunit lub tropomiozyny.
Troponina I lub TNI, nieco ponad 180 odpadów aminokwasowych, ma taką samą masę cząsteczkową jak troponina T, ale w swojej strukturze ma specjalne miejsca do przyłączenia się do aktyny, blokując interakcję między tym drugim a miozyną, która jest zjawiskiem odpowiedzialnym dla skurczu włókien mięśniowych.
Wiele podręczników odnosi się do tej podjednostki, takich jak podjednostka hamująca i jako molekularna „wkleja” między trzema podjednostkami troponiny. Jego zdolność do zjednoczenia do aktyny i aktywności hamującej jest wzmocniona przez jej związek z tropomiozyną, za pośrednictwem podjednostki TNT.
Wykazano, że w podjednostce I region sekwencji odpowiedzialnej za hamowanie jest definiowany przez centralny peptyd 12 odpadów aminokwasowych między pozycjami 104 i 115; i że C-końcowy region podjednostki ma również funkcję podczas hamowania.
Funkcje
Główna funkcja troponiny w skurczu mięśni zależy od jej zdolności do łączenia wapnia, ponieważ to białko jest jedynym składnikiem cienkich włókien w prążkowanym mięśniu.
W przypadku braku troponiny cienkie włókna są zdolne do łączenia grubych włókien i kurczenia się, niezależnie od wewnątrzkomórkowego stężenia wapnia, więc funkcją troponiny jest unikanie skurczu przy braku wapnia poprzez jego związek z tropomiozyną.
Może ci służyć: OvuliparosZatem troponina odgrywa ważną rolę w utrzymaniu rozluźnienia mięśni, gdy nie ma wystarczającej ilości wewnątrzkomórkowego wapnia, aw skurczu mięśni, gdy nerwowy bodziec elektryczny umożliwia wejście wapnia do włókna mięśniowego.
Jak to się stało?
W mięśniach szkieletowych i sercowych skurcz mięśni występuje dzięki interakcji między cienkimi i grubymi włókienami, które przesuwają się po sobie.
W komórkach tych mięśni wapń jest niezbędny do interakcji aktorskiej-mulozyny (cienki i grube włókna), ponieważ miejsca związkowe aktyny dla miozyny są „ukryte” przez wspólne działanie tropomiozyny i troponiny, co reaguje do wapnia.
Jony wapnia pochodzące z retikulum sarkoplazmatycznego (retikulum endoplazmatyczne włókien mięśniowych) wiążą się z podjednostką C troponiny, która neutralizuje hamowanie za pośrednictwem troponiny, a skurcz mięśni jest wyzwalany.
„Neutralizacja” hamowania spowodowanego przez podjednostkę I występuje po zjednoczeniu wapnia do podjednostki C, która generuje zmianę konformacyjną, która rozprzestrzenia się między trzema podjednostkami i pozwala na dysocjację zarówno cząsteczek aktyny, jak i tropomiozyny.
To dysocjacja między troponiną, tropomiozyną i aktyną naraża w aktywach miejsc Unii dla miozyny. Zatem kuliste głowy tych ostatnich mogą oddziaływać z włóknami aktyny i inicjować skurcz zależny od ATP z powodu przemieszczenia jednego filamentu na drugi.
Test troponiny
Troponina jest preferowanym biomarkerem do wykrywania zmian sercowych. Dlatego test troponiny jest szeroko stosowany w diagnostyce biochemicznej, wczesnej i/lub zapobiegawczej, w niektórych stanach patologicznych sercowych, takich jak ostry zawał mięśnia sercowego.
Wielu lekarzy uważa, że ten test ułatwia podejmowanie decyzji w odniesieniu do tego, co robić i jakie leczenie podawania pacjentów, którzy mają ból w klatce piersiowej.
Ogólnie rzecz biorąc, jest to związane z wykrywaniem podjednostek T i I troponiny, ponieważ troponina C isforma występuje również w mięśniach szkieletowych powolnego skurczu; to znaczy nie jest specyficzne dla serca.
Jaki jest test troponiny?
Test troponiny jest zwykle badaniem odpornościowym, które wykrywa izoformy sercowe podjednostek T i I troponiny. Następnie opiera się na różnicach, które istnieją między obiema izoformami.
Może ci służyć: synteza białekIzoforia podjednostki toponiny I (CTNI) (CTNI)
W tkance mięśniowej mięśnia sercowego znajduje się tylko jedna izoforma podjednostki i troponiny, charakteryzująca się obecnością „ogona” posttranslacyjnego 32 aminokwasów na jego N-końcowym końcu.
Ta izoforma jest wykrywana dzięki rozwojowi określonych przeciwciał monoklonalnych, które nie rozpoznają innych izoform niekardiologicznych, ponieważ ogon aminokwasowy jest mniej więcej 50% różni się od końcach innych izoform.
CTNI nie jest wyrażane w uszkodzonych tkaninach, ale jest wyłączne dla dorosłych tkanki serca.
Izoforia podjednostki troponiny T (CTNT) (CTNT)
Izoforia sercowa podjednostki T troponiny jest kodowana w trzech różnych genach, których ARNM może ponieść alternatywne cięcia i spania, które powodują wytwarzanie izoform ze zmiennymi sekwencjami na końcach N i C-końcowych.
Chociaż mięśnie sercowe ludzi zawiera 4 izoformy TNT, tylko jedna jest cechą tkanki serca dorosłego. Jest to wykrywane za pomocą określonych przeciwciał zaprojektowanych w stosunku do N-końcowego końca jego sekwencji aminoacidalnej.
Testy „nowej generacji” podjednostki t izoformy serca zwracają dużą uwagę na fakt, że niektóre uszkodzone tkanki szkieletowe mogą ponownie ekspresować tę izoforię, więc reakcje krzyżowe można uzyskać za pomocą przeciwciał.
Bibliografia
- Babuin, L., & Jaffe, a. S. (2005). Troponina: biomarker z wyboru do wykrywania uszkodzenia serca. CMAJ, 173(10), 1191-1202.
- Collinson, s. 1., Stubbs, str., & Kessler, a.-C. (2003). Wieloośrodkowa ocena wartości diagnostycznej troponiny sercowej T, CK-MB i mioglobiny w celu oceny pacjentów z podejrzanymi ostrymi zespołami wieńcowymi w rutynowej praktyce klinicznej praktyki klinicznej. Serce, 89, 280-286.
- Farah, c., & Reinach, F. (1995). Kompleks troponiny i regulacja skurczu mięśni. FASEB, 9, 755-767.
- Keller, t., Peetz, d., Tzikas, s., Roth, a., CZYZ, e., Bickel, c.,... Blankenberg, S. (2009). Wrażliwa troponina I test we wczesnej diagnozie ostrej zawodowej mięśnia sercowego. The New England Journal of Medicine, 361(9), 868-877.
- Ross, m., & Pawlina, w. (2006). Histologia. Tekst i atlas z skorelowaną biologią komórki i molekularną (Ed.). Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Mechanizm regulacji wapnia skurczu mięśni. W dążeniu do podstaw strukturalnych. Proc. Jpn. Acade. Być. B, 91, 321-350.
- « Charakterystyka, struktura i funkcje tropomiozyny
- Ustalona koncepcja ciepła, formuły i ćwiczenia »

