Charakterystyka troniny, funkcje, degradacja, korzyści
- 3601
- 957
- Marianna Czarnecki
Treonina (Thr, T) lub kwas Treo-α-amino-β-butyryczny jest jednym z składowych aminokwasów białek komórkowych. Ponieważ człowiek i inne zwierzęta kręgowca nie mają biosyntetycznych dróg do swojej produkcji, Treonine jest uważana za jedną z 9 niezbędnych aminokwasów, które należy zdobyć za pomocą diety.
Treonine była ostatnią z 20 wspólnych aminokwasów odkrytych w białkach, co miało miejsce w historii ponad sto lat po odkryciu asparaginy (1806), która była pierwszym opisanym aminokwasem.
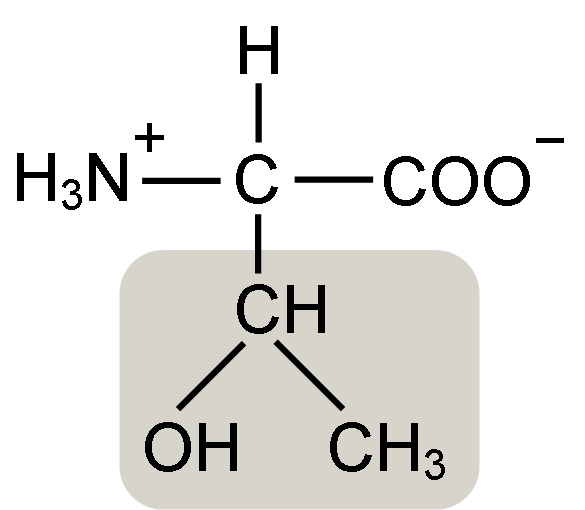
 Struktura aminokwasów treoniny (źródło: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura aminokwasów treoniny (źródło: Keycin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Został odkryty przez Williama Cumminga Rose w 1936 r., Który wymyślił termin „treonine” podobieństwu strukturalnego, które znalazł między tym aminokwasem a kwasem haraonowym, związkiem pochodzącym z cukru treose.
Jako białko aminokwasowe, treonina ma wiele funkcji w komórkach, wśród których miejsce wiązania łańcuchów węglowodanów typowych dla glikoprotein i miejsca rozpoznawania kinaz białkowych o określonych funkcjach (białka zawodowe/kinazy serynowe) wyróżniają się)).
Podobnie, Treonina jest niezbędnym składnikiem białek, takich jak szkliwo dentystyczne, elastyna i kolagen, a także ma ważne funkcje w układzie nerwowym. Jest stosowany jako suplement pokarmowy i jako „mitigator” fizjologicznych stanów lęku i depresji.
[TOC]
Charakterystyka
Treonina należy do grupy aminokwasowej polarnej, która ma grupę łańcucha R lub boczną, pozbawioną obciążeń dodatnich lub ujemnych (niezłośne aminokwasy polarne).
Charakterystyka jej grupy R jest wykonana przez wysoce rozpuszczalny aminokwas (hydrofilowy lub hydrofilowy), co jest również prawdziwe w przypadku innych członków tej grupy, takich jak cysteina, seryna, asparagina i glutamina.
Wraz z tryptofanem, fenyloalaniną, izoleucyną i tyrozyną, treonina jest jednym z pięciu aminokwasów, które mają zarówno funkcje glukogenne, jak i ketogenne, ponieważ z jej metabolizmu istnieją istotne pośredniki, takie jak pirogronian i sugerylu-CoA.
Ten aminokwas ma przybliżoną masę cząsteczkową 119 g/mol; Podobnie jak wiele aminokwasów bez obciążenia, ma punkt izoelektryczny około 5.87 i jego częstotliwość w strukturach białkowych jest blisko 6%.
Niektórzy autorzy grupują Treonine razem z innymi aminokwasami „słodkiego” smaku, wśród których są na przykład seryna, glicyna i alanina.
Struktura
Α-aminokwasy, takie jak treonina, mają ogólną strukturę, to znaczy dla wszystkich jest powszechne. Wyróżnia się to obecnością atomu węgla znanego jako „węgiel α”, który jest chiralny i do którego połączono cztery typy cząsteczek lub różnych podstawników.
Ten węgiel ma jedno ze swoich wiązań z atomem wodoru, drugą z grupą R, która jest charakterystyczna dla każdego aminokwasu, a pozostałe dwa są zajęte przez grupy aminowe (NH2) i karboksyl (COOH), które są wspólne dla wszystkich Aminokwasy.
Grupa tonine R ma grupę hydroksylową, która pozwala jej tworzyć mosty wodorowe z innymi cząsteczkami w pożywce wodnej. Jego tożsamość można zdefiniować jako grupę alkoholową (etanol z dwoma atomami węgla), która straciła jeden z jego hydrogenów, aby dołączyć do atomu węgla α (-Chah-CH3).
Ta grupa -OH może służyć jako „most” lub miejsce związkowe dla różnych cząsteczek (można to połączyć, na przykład łańcuchy oligosacharydów podczas tworzenia glikoprotein), więc jest to jeden z osób odpowiedzialnych za utworzenie tworzenia się Zmodyfikowane pochodne Treonine.
Biologicznie aktywną postacią tego aminokwasu jest L-Tronina i właśnie to uczestniczy zarówno w tworzeniu struktur białkowych, jak i w różnych procesach metabolicznych, w których działa.
Funkcje
Jako białko aminokwasowe, treonina jest częścią struktury wielu białek w naturze, gdzie jego znaczenie i bogactwo zależą od tożsamości i funkcji białka, do której należy.
Może ci służyć: heterosis: poprawa zwierząt, roślin, istoty ludzkiejOprócz jego funkcji strukturalnych w tworzeniu sekwencji peptydowej białek, tremena wypełnia inne funkcje zarówno w układzie nerwowym, jak i w wątrobie, gdzie uczestniczy w metabolizmie tłuszczów i zapobiega jej akumulacji w tym narząd.
Treonina jest częścią sekwencji rozpoznanych przez enzymy kinazy serín/treonina, które są odpowiedzialne za liczne procesy fosforylacji białek, niezbędne do regulacji mnogości funkcji i wewnątrzkomórkowych zdarzeń sygnalizacyjnych.
Jest również stosowany w leczeniu niektórych zaburzeń jelitowych i trawiennych oraz jego przydatność w tłumieniu chorób patologicznych, takich jak lęk i depresja.
L-Treonina jest również jednym z aminokwasów wymaganych do utrzymania pluripotencjalnego stanu mysich zarodkowych komórek macierzystych, co najwyraźniej jest związane z metabolizmem S-adenozylo-metioniny i zdarzeniami metylacji histonów, które są bezpośrednio bezpośrednio zaangażowany w ekspresję genów.
W przemyśle
Wspólną właściwością dla wielu aminokwasów jest jego zdolność do reagowania z innymi grupami chemicznymi, takimi jak aldehydy lub ketony do tworzenia charakterystycznych „smaków” wielu związków.
Wśród tych aminokwasów jest treonina, która jako seryn, reaguje z sacharozą podczas TOS.
Treonina jest obecna w wielu lekach naturalnego pochodzenia, a także w wielu preparatach suplementów diety, które są przepisywane pacjentom z niedożywieniem lub mają słabe diety w tym aminokwasie.
Kolejna z najbardziej znanych funkcji L-Tronine, która rośnie z czasem, jest addytywna w przygotowaniu skoncentrowanej żywności dla świń i branż produkcji drobiu.
L-Tronina jest stosowana w tych branżach jako suplement pokarmowy w słabych formulacjach z białka, ponieważ zapewnia to korzyści ekonomiczne i łagodzi surowe niedobory białka, które te zwierzęta gospodarskie spożywają.
Główna forma produkcji tego aminokwasu jest zwykle fermentacja drobnoustrojowa i światowa produkcja do celów rolniczych w 2009 r. Przekroczyła 75 ton.
Biosynteza
Treonine jest jednym z dziewięciu niezbędnych aminokwasów dla człowieka, co oznacza, że nie można jej syntetyzować przez komórki ciała, a zatem, które należy uzyskać z białek pochodzenia zwierzęcego lub rośliny, które są dostarczane z Daily Diet Diet.
Rośliny, grzyby i bakterie syntetyzują trereoninę z podobnych tras, które mogą przedstawić sobie pewne rozbieżności. Jednak większość z tych organizmów zaczyna od Asparto jako prekursora, nie tylko dla Treoniny, ale także dla metodiny i lizyny.
Trasa biosintetyczna w drobnoustrojach
Droga biosyntezy L-Troniny w mikroorganizmach, takich jak bakterie, składa się z pięciu kroków katalizowanych przez różne enzymy. Podłoża odlotu, jak skomentowano, jest asparaginianem, który jest fosforylowany przez enzym ATP Asparasa Asparagate.
Ta reakcja wytwarza metabolit fosforan L-asphat (L-aspartil-P), który służy jako substrat dla półdehydowej dehydrogenazy aspartylowej aspartogenazy, który katalizuje jej konwersję do pół-zależnych od półprzestrzennych zależnych od półprzestrzennych aspartylu.
Semiardhaide aspartyl można stosować zarówno do biosyntezy L-Lisin, jak i do biosyntezy L-Troniny; W takim przypadku cząsteczka jest stosowana przez zależną od homoserine enzym zależną.
L-homoseryna jest fosforylowana do fosforanu L-homoseriny (L-homoserina-P) przez kinazę zależną od ATP homoseryną i wspomniany produkt reakcji jest z kolei substratem syntazy enzymu toniine, zdolnego do syntezy L- +-Trinina.
L-metionina może być syntetyzowana z l-homoseriny wytwarzanej w poprzednim kroku, więc stanowi ona „konkurencyjną” drogę do syntezy L-Troniny.
Zsyntetyzowana L-Tronina w ten sposób może być stosowana do syntezy białek lub może być również stosowana w dół do syntezy glicyny i L-leucyny, dwóch istotnych aminokwasów również z białka punktu widzenia.
Może ci służyć: teorie ewolucyjneRozporządzenie
Należy podkreślić, że trzy z pięciu enzymów uczestniczących w biosyntezie L-Troniny w bakteriach są regulowane przez produkt reakcji przez ujemne sprzężenie zwrotne. Są to asparaginian kinazy, dehydrogenaza homoseryna i kinaza homoseryna.
Ponadto regulacja tej trasy biosyntetycznej zależy również od wymagań komórkowych innych związanych z nią produktów biosyntetycznych, ponieważ tworzenie L-lizyny, L-metioniny, L-izoleucyny i glicyny zależy od trasy produkcyjnej produkcji produkcji L-Treonine.
Degradacja
Treoninę można degradować dwiema różnymi trasami w celu wytworzenia pirogronianu lub sucynylo-CoA. Ten ostatni jest najważniejszym produktem katabolizmu Treonine u ludzi.
Metabolizm Treonine występuje głównie w wątrobie, ale trzustka, choć w mniejszym stopniu, również uczestniczy w tym procesie. Ta trasa zaczyna się od transportu aminokwasu przez błonę plazmatyczną hepatocytów za pomocą określonych transporterów.
Produkcja pirogronianu z Treonine
Konwersja tremeniny na pirogronian następuje dzięki jej transformacji w glicynę, która ma miejsce w dwóch etapach katalitycznych, które zaczynają się od tworzenia się 2-amino-3-akotobutiranu z treeoniny i przez działanie enzymu dehydrogenazy trereoniny.
W ludzkiej istocie droga ta reprezentuje tylko od 10 do 30% katabolizmu Treonine, jednak jej znaczenie jest w stosunku do organizmu, który jest rozważany, ponieważ na przykład u innych ssaków jest to znacznie bardziej istotne rozmowy kataboliczne.
Produkcja sukcynisty z Treonina
Podobnie jak w przypadku metioniny, walena i izoleucyny, atomy węgla treoniny są również wykorzystywane do produkcji Suctunil-CoA. Proces ten rozpoczyna się od konwersji aminokwasu w α-cetobutirat, który jest następnie stosowany jako substrat enzymu dehydrogenazy α-Z-Z-Stoat.
Transformacja treoniny w α-cetobutirat jest katalizowana przez dehydratazę enzymu, która implikuje utratę cząsteczki wody (H2O) i innej jonu amonu (NH4+).
Propionilo-CoA jest karboksylowany w metylomalonylo-CoA poprzez dwustopniową reakcję, która wymaga wprowadzenia atomu węgla wodorowęglanowego (HCO3-). Produkt ten służy jako substrat dla metylomalonilu-CoA Mutasa-Coenzyme B12, który „epimeryzuje” cząsteczkę w celu wytworzenia sumynylo-CoA.
Inne produkty kataboliczne
Dodatkowo szkielet węglowy treoniny można katabolicznie stosować do produkcji acetylo-CoA, co ma również ważne implikacje z punktu energetycznego widzenia w komórkach ciała.
W niektórych organizmach Treonine działa również jako substrat niektórych tras biosyntetycznych, takich jak na przykład izoleucyna. W tym przypadku, poprzez 5 etapów katalitycznych, α-ecthobutiran pochodzący z katabolizmu treoniny można skierować w kierunku tworzenia izoleuukiny.
Pokarmy bogate w treonine
Chociaż większość obfitych pokarmów w białku ma pewien odsetek wszystkich aminokwasów, ustalono, że jaja, mleko, soja i żelatyna są szczególnie bogate w aminokwas Treonine.
Treonine jest również w mięsach zwierzęcych, takich jak kurczak, świnia, królik, jagnię i różne rodzaje ptaków. W żywności pochodzenia roślinnego jest obficie w cholesach, na cebuli, czosnku, chard i bakłażan.
Występuje również w ryżu, kukurydzy, otrębach pszenicy, ziarnach roślin strączkowych oraz w wielu owocach, takich jak truskawki, banany, winogrona, ananasa, śliwki i inne orzechy bogate w białko, takie jak orzechy lub pistacje, między innymi,.
Korzyści z Twojego spożycia
Według komitetu ekspertów Światowej Organizacji Zdrowia ds. Rolnictwa i Żywności (WHO, FAO), codzienne zapotrzebowanie Treoniny dla przeciętnego dorosłego człowieka wynosi około 7 mg na kilogram masy ciała, które należy zdobyć z żywności połkniętej z dietetyką z dietetyką.
Może ci służyć: czerwony fenol: cechy, przygotowanie, zastosowaniaLiczby te pochodzą z danych eksperymentalnych uzyskanych z badań przeprowadzonych z mężczyznami i kobietami, w których ta ilość tremeniny jest wystarczająca, aby uzyskać dodatnią równowagę azotu w komórkach ciała.
Jednak badania z dziećmi w wieku od 6 miesięcy do jednego roku wykazały, że w przypadku minimalnych wymagań L-Troniny wynoszą od 50 do 60 mg na kilogram masy dziennie.
Wśród głównych korzyści spożycia suplementów odżywczych lub leków ze specjalnymi preparatami bogatymi w L-Troninę jest leczenie bocznego stwardnienia azotroficznego lub choroby Lou Gehrig.
Dodatkowe zaopatrzenie w treonine sprzyja wchłanianiu składników odżywczych w jelicie, a także przyczynia się do poprawy funkcji wątroby. Jest to również ważne dla transportu grup fosforanowych przez komórki.
Zaburzenia niedoboru
U małych dzieci narodzą się wady w metabolizmie Treonine, które powodują opóźnienie wzrostu i inne powiązane zaburzenia metaboliczne.
Niedobory tego aminokwasu związane są z pewnymi niepowodzeniami przybierania na masy dziecka, oprócz innych patologii związanych z brakiem zatrzymywania azotu i jego utraty moczu.
Ludzie poddane złym dietom w Treoninie mogą mieć większą skłonność do cierpienia na stłuszczenie wątroby i niektóre infekcje jelitowe związane z tym aminokwasem.
Bibliografia
- Barret, g., & Elmore, D. (2004). Aminokwasy i peptydy. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Och. H., Condon, m., & Young, v. R. (2002). Zapotrzebowanie na treoninę zdrowych osób dorosłych, z 24-godzinnym wskaźnikiem techniki równowagi aminokwasowej. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, godz. (1931). Historia odkrycia aminokwasów. Ii. Przegląd aminokwasów opisanych od 1931 r. Jako składniki natywnych białek. Postęp w chemii białek, 81-171.
- Champe, str., & Harvey, r. (2003). Aminokwasy aminokwasy. W Ilustrowane recenzje Lippincott: Biochemia (Wyd., pp. 1-12). Lippincott.
- De Lange, C. F. M., Gillis, a. M., & Simpson, G. J. (2001). Wpływ spożycia treoniny na odkładanie białka-ciała Whoe i przyjęcie treoniny w rosnących dietach karmionych świniami karmionymi. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., Blumenthal, d., I Krebs i. (1987). Białko kinazy serynowej/treoniny. Annu. Obrót silnika., 56, 567-613.
- Edsall, J. (1960). Aminokwasy, białka i biochemia raka (Tom. 241). Londyn: Academic Press, Inc.
- Dom, J. D., Hall, ur. N., I Brosnan, J. T. (2001). Metabolizm treoninowy w izolowanych hepatocytach szczura. American Journal of Physiology - Endocrinology and Metabolizm, 281, 1300-1307.
- Hudson, ur. (1992). Biochemia białek żywnościowych. Springer-Science+Business Media, b.V.
- Kaplan, m., & Flavin, m. (1965). Biosynteza treoniny. Na ścieżce grzybów i bakterii oraz mechanizmu reakcji izomeryzacji. The Journal of Biological Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (1996). L-Threonina dla drobiu: recenzja. Applied Poultry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, s. 1., & Holt i. (1954). Wymaganie treoninowe normalnego niemowlęcia. Journal of Nutrition, 10(56), 231-251.
- Rigo, J., & Senterre, j. (1980). Optymalne spożycie treoniny w przypadku przedwczesnego zakazującego odżywiania doustnego lub pozajelitowego. Journal of Fifiging and Enteralal Nutrition, 4(1), 15-17.
- Shyh-Chang, n., Locasale, J. W., Lysssiotis, c. DO., Zheng i., Teo, r. I., Ratanasirintrawoot, s.,... Cantley, L. C. (2013). Wpływ metabolizmu treoniny na metylację S-Adnenezylometioninę i histon. Nauka, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. DO. (1931). Historia odkrycia aminokwasów. Recenzje chemiczne, 9(2), 169-318.
- MD Web. (N.D.). Pobrano 10 września 2019 r. Z WWW.Webmd.com/witaminy/ai/incredientmono-1083/threonine
- Wormser, e. H., & Pardee, do. B. (1958). Regulacja biosyntezy treoniny w Escherichia coli. Archiwa biochemii i biofizyki, 78(2), 416-432.
- Xunyan, x., Quinn, s. 1., & Xiaoyuan, x. (2012). Brama badawcza. Pobrano 10 września 2019 r. Z WWW.Researchgate.Net/figure/biosynteza-ścieżka-l-threonina-The-Pathway-konssenci-Fi-Fi-enzymmatic-Steps_fig1_232320671

