Struktura toluenu, właściwości, użycia, uzyskiwanie
- 1026
- 199
- Eugenia Czapla
On Toluen Jest to aromatyczny węglowodór, którego skondensowana wzór to C6H5Ch3 lub phch3 i składa się z grupy metylowej (CH3) wraz z pierścieniem benzenicznym lub grupą fenylową (pH). Naturalnie występuje w ropie naftowej, w węglu, w wulkanach i w niektórych drzewach, takich jak Tolú de América na południu.
Ten charakterystyczny rozpuszczalnik zapachu jest używany głównie jako surowiec przemysłowy i jako rozcieńczony farba. Jest również stosowany w eliminacji pasożytów obecnych u kotów i psów, takich jak Ascarids i Anylostomy.
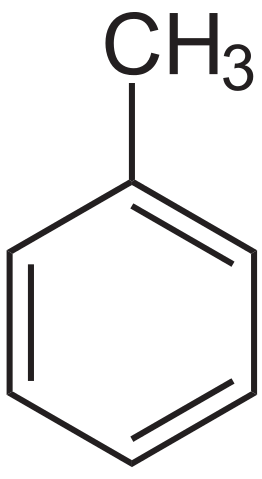
 Formuła strukturalna toluenowego. Źródło: Neuropoger przez Wikipedia.
Formuła strukturalna toluenowego. Źródło: Neuropoger przez Wikipedia. Toluen po raz pierwszy izolowano Pierre-Joseph Pelletier i Philippe Walter w 1837 r. Następnie Henri Etienne Sainte-Claire Deville w 1841 r. W 1843 r. Berzelius ochrzcił go jako toluin.
Większość toluenu jest uzyskiwana jako produkt boczny lub wtórny w procesach produkcji gazu i konwersji węgla w koks. Jest to również wytwarzane przez reakcje dokonane w laboratorium, na przykład reakcja benzenu z chlorkiem metylu.
[TOC]
Struktura
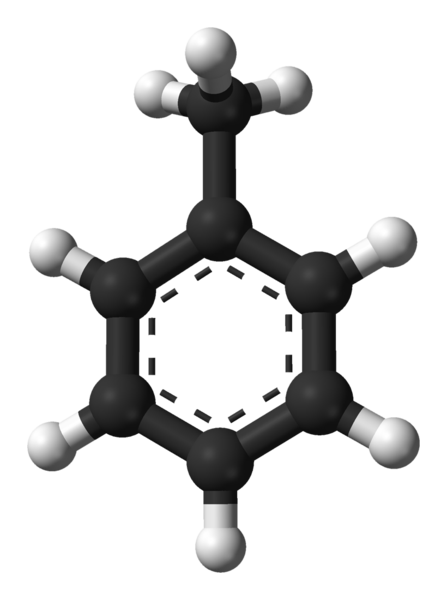 Struktura molekularna toluenu. Źródło: Ben Mills przez Wikipedia.
Struktura molekularna toluenu. Źródło: Ben Mills przez Wikipedia. Na lepszym obrazie mamy strukturę molekularną toluenu reprezentowaną przez model kulek i prętów. Zauważ, że wygląda dokładnie tak samo, jak wskazano formuła strukturalna, z różnicą, że nie jest to całkowicie płaska cząsteczka.
Na środku pierścienia benzenowego, który w tym przypadku można postrzegać jako grupa fenylowa, pH, jego aromatyczny charakter jest podkreślany przez kropkowane linie. Wszystkie atomy węgla mają hybrydyzację SP2, Z wyjątkiem grupy Cho3, którego hybrydyzacja jest sp3.
Z tego powodu cząsteczka nie jest całkowicie płaska: hydrogeny cho3 Znajdują się pod różnymi kątami benzenicznej płaszczyzny pierścieniowej.
Może ci służyć: stała jonizacjiToluen jest cząsteczką apolarną, hydrofobową i aromatyczną. Jego interakcje międzycząsteczkowe oparte są na siłach dyspersyjnych w Londynie i w interakcjach Dipolo-Dipolo, ponieważ środek pierścienia jest „załadowany” gęstości elektronicznej zapewnianej przez CH3; Podczas gdy atomy wodoru mają niską gęstość elektroniczną.
Dlatego toluen ma kilka rodzajów interakcji międzycząsteczkowych, które utrzymują cząsteczki ich ciekłego spójnego. Znajduje to odzwierciedlenie w temperaturze wrzenia, 111 ° C, co jest wysokie, biorąc pod uwagę, że jest to rozpuszczalnik apolowy.
Nieruchomości
Wygląd fizyczny
Bezbarwny i przezroczysty ciecz
Masa cząsteczkowa
92 141 g/mol
Zapach
Słodki, akr i podobny do benzenu
Gęstość
0,87 g/ml w 20 ° C
Temperatura topnienia
-95 ° C
Punkt wrzenia
111 ° C
Rozpuszczalność
Toluen ma nikczemną rozpuszczalność w wodzie: 0,52 g/l w 20 ° C. To ze względu na różnicę polaryzacji między toluenem a wodą.
Z drugiej strony toluen jest rozpuszczalny lub w tym przypadku mieszany z etanolem, benzenem, eterem etylowym, acetonem, chloroformem, lodowatym kwasem octowym i disiarczkiem węgla; Oznacza to, że lepiej jest rozpuszczony w mniej polarnych rozpuszczalnikach.
Wskaźnik refrakcji (nD)
1 497
Breja
0,590 CP (20 ° C)
punkt zapłonu
6 ° C. Toluen musi być manipulowany w obozach wydobywających gaz i jak najdalej od jakiegokolwiek płomienia.
Gęstość pary
3.14 w relacji powietrznej = 1. To znaczy ich opary są trzykrotnie gęstsze niż powietrze.
Ciśnienie pary
2.8 kPa w 20 ° C (około 0.27 atm).
Temperatura samowystarczalności
480 ° C
Rozkład
Może energicznie reagować z materiałami utleniającymi. Po podgrzaniu do rozkładu emituje akr i irytujący dym.
Napięcie powierzchniowe
29,46 mn w 10 ° C
Moment dipolarny
0,36 d
Reaktywność
Toluen jest podatny na chlorowanie do produkcji orto-chlorotoluenu i para-cllorotoluenu. Łatwo jest również dostarczyć nitrotoluen, który jest surowcem barwników.
Może ci służyć: waga atomowaCzęść toluenu łączy się z trzema częściami kwasu azotowego, aby powodować trinitrotoluen (TNT): jeden z najbardziej znanych materiałów wybuchowych.
Podobnie toluen doświadcza sulfonowania w celu wygenerowania kwasów o-toluen-sulfonowych i p-toluen-sulfonowych, które są surowcem do produkcji barwników i sacharyny.
Grupa toluenowego metylowego doświadcza utraty wodoru z powodu działania silnej zasady. Grupa metylowa jest również podatna na utlenianie, więc reaguje z permangananem potasu, powodując, że pochodzą benzoiczne i benzaldehydu.
Aplikacje
Przemysłowcy
 TNT, najbardziej symboliczny wybuch ze wszystkich, występuje przez toluen jako główny surowiec. Źródło: Pixabay.
TNT, najbardziej symboliczny wybuch ze wszystkich, występuje przez toluen jako główny surowiec. Źródło: Pixabay. Toluen jest używany w opracowywaniu obrazów, rozcieńczalników farb, polerowanych paznokci, klejów lub dziąseł pasty, lakierów, atramentów, nylonu, plastiku, pianki poliuretanowej, większości olejków, narządów winylowych, leków, barwników, niedoborów, wybuchów (TNT).
W ten sam sposób toluen jest używany w postaci toluenosulfonados w produkcji detergentu. Toluen ma również ogromne znaczenie w produkcji cementów z tworzywa sztucznego, kosmetycznych stawek do barwienia, przebiegu, atramentów, asfaltu, stałych markerów, cementów kontaktowych itp.
Rozpuszczalnik i rozcieńczenie
Toluen jest używany do rozcieńczenia obrazów, co ułatwia jego zastosowanie. Służy do rozpuszczenia krawędzi zestawów polistyrenowych, umożliwiając w ten sposób połączenie części, które stanowią modele samolotów skalnych. Ponadto jest stosowany w ekstrakcji naturalnych produktów z roślin.
Toluen to rozpuszczalnik atramentowy używany w wygrawerowanym otworze. Cementy zmieszane z gumą i toluenem są używane do pokrycia dużej liczby produktów. Podobnie toluen jest używany jako rozpuszczalnik w atramentach drukowanych, lakierach, skórzanych garbnikach, klejach i środkach dezynfekujących.
Może ci służyć: pochłanianie trzonoweI jeszcze bardziej interesujący, toluen jest używany jako rozpuszczalnik nanomateriałów węglowych (takich jak nanorurki) i Fullerenos.
Inni
Do benzyny dodaje się mieszaninę benzenu, toluenu i ksylenu (BTX) w celu zwiększenia oktanowej. Tolueen to dodatek gazu samolotu i rezerwatu o wysokiej zawartości oktanowej. Jest również stosowany w opracowaniu NAFTA.
Toluen pomaga w eliminacji niektórych gatunków Ascárides i Anquilostomos, a także w tesiach, które są pasożytami kotów i psów.
Uzyskanie
Większość toluenu uzyskuje się z produktów destylowanych z ropy naftowej, wytwarzanej podczas pirolizy węglowodorowej (pękanie pary). Katalityczna reforma oparów naftowych reprezentuje 87 % wyprodukowanego toluenu.
Dodatkowe 9 % toluenu z pirolizy benzyny wytwarzanych podczas produkcji etylenu i propylenu.
Hulla smoła piekarników koksowych przyczynia się do 1 % wytwarzanego toluenu, podczas gdy pozostałe 2 % uzyskuje się jako produkt uboczny produkcji odcinka.
Szkodliwe efekty
Toluen jest rozpuszczalnikiem, który jest wdychany w celu uzyskania wysokości, ponieważ ma działanie narkotyczne, które wpływa na funkcjonowanie ośrodkowego układu nerwowego. Toluen wchodzi do ciała w celu spożycia, wdychania i wchłaniania przez skórę.
Na poziomie ekspozycji 200 ppm, wzbudzenie, euforia, halucynacje, zniekształcone postrzeganie, ból głowy i zawroty głowy. Podczas gdy wyższy poziom ekspozycji toluenowej może powodować depresję, senność i odstręt.
Gdy inhalacja przekracza stężenie 10.000 ppm, jest w stanie wytworzyć śmierć jednostki z powodu niewydolności oddechowej.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- National Center for Biotechnology Information. (2020). Toluen. Baza danych Pubchem., CID = 1140. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2020). Toluen. Źródło: w:.Wikipedia.org
- Engineering Toolbox, (2018). Toluen - Właściwości termofysowe. [Online] Odzyskane z: EngineeringToolbox.com
- Vedantu. (S.F.). Toluen. Odzyskane z: Vedantu.com
- « Niszczycielski wzór i równania, przykłady, ćwiczenia
- Struktura poliwilupirolidonu, właściwości, zastosowania, skutki uboczne »

