Charakterystyka tyrozyny, struktura, funkcje, korzyści
- 2448
- 328
- Estera Wojtkowiak
Tyrozyna (Tyr, y) jest jednym z 22 aminokwasów, które tworzą białka wszystkich komórek obecnych w żywych istotach. W przeciwieństwie do innych aminokwasów, takich jak Valine, Treonina, tryptofan, leucyna, lizyna i inne, tyrozyna jest „warunkowo” zasadniczo niezbędnym aminokwasem.
Nazwa „tyrozyna” pochodzi od greckiego słowa "strzelanie", co oznacza ser, ponieważ ten aminokwas został po raz pierwszy odkryty w tym jedzeniu. Termin został wymyślony w 1846 roku przez Liebig, który mieszał ser z wodorotlenkiem potasu i uzyskał nieznany związek, prawie rozpuszczalny w wodzie.
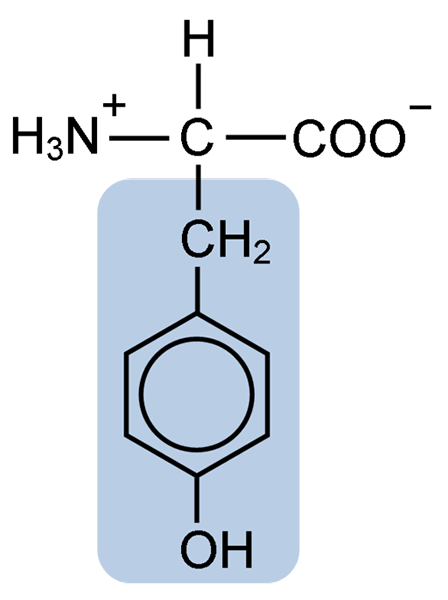
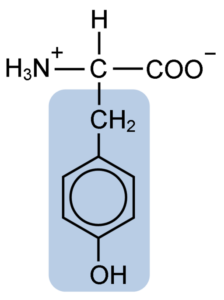 Struktura chemiczna aminokwasu tyrozynowego (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasu tyrozynowego (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Po początkowym opisie inni badacze, tacy jak Warren de la Rue i Hinterberger uzyskane odpowiednio z owadów i rogów rogów. Jego oddzielenie od hydrolizy innych białek za pomocą kwasu solnego opisano w 1901 r.
Ogólnie rzecz biorąc, aminokwas jest uzyskiwany u ssaków dzięki hydroksylacji fenyloalaniny, chociaż jest również wchłaniany w jelicie z białek spożywanych z żywnością.
Tyrozyna ma wiele funkcji w ludzkim ciele, a wśród nich najbardziej odpowiednie są być może podłoże do produkcji neuroprzekaźników i hormonów, takich jak adrenalina i hormon tarczycy.
[TOC]
Charakterystyka
Tyrozyna waży około 180 g/mol, a jej grupa łańcucha R lub bocznego ma stałą 10 -dissocjacji 10.07. Jego względna obfitość w białkach komórkowych nie przekracza 4%, ale ma wiele podstawowych funkcji dla fizjologii ludzkiej.
Ten aminokwas należy do grupy aromatycznych aminokwasów, w której fenyloalanina i tryptofan są również. Członkowie tej grupy mają pierścienie aromatyczne w swoich łańcuchach r r lub bocznych i zwykle są hydrofobowymi lub apolarnymi aminokwasami.
Podobnie jak tryptofan, tyrozyna pochłania światło ultrafioletowe i jest jednym z odpadów aminokwasowych odpowiedzialnych za absorbancję światła do 280 nm wielu białek, więc jest przydatna do jego charakterystyki.
Jest uważany za niezbędny „warunkowo” aminokwas, ponieważ jego biosynteza w człowieku zależy od fenyloalaniny, niezbędnego aminokwasu. Jeśli organizm spełnia swoje codzienne wymagania fenyloalaniny, tyrozyna może zostać zsyntetyzowana bez problemu i nie jest ograniczającym aminokwasem.
Jeśli jednak dieta brakuje fenyloalaniny, ciało będzie miało nierównowagę tego aminokwasu, ale także tyrozyny. Należy również wskazać, że reakcja syntezy tyrozyny z fenyloalaniny nie jest odwracalna, więc tyrozyna nie może zaspokoić potrzeb komórkowych fenyloalaniny.
Tyrozyna należy również do grupy aminokwasowej z podwójnymi funkcjami w wytwarzaniu glukogennych i ketogennych pośredników metabolicznych, które uczestniczą w syntezie glukozy dla mózgu i tworzeniu ciał ketonowych w wątrobie.
Struktura
Podobnie jak reszta aminokwasów, tyrozyna lub β-parahydroksyfenylo-α-amino-amino, jest to α-aminokwas, który ma centralny atom węglowy, zwany węglowym α i który jest chiralny, ponieważ jest on powiązany Cztery różne atomy lub cząsteczki podstawnikowe.
Ten quiralny węgiel jest powiązany z dwiema charakterystycznymi grupami aminokwasów: grupą aminową (NH2) i grupy karboksylowej (COOH). Dzieli także jedno ze swoich wiązań z atomem wodoru, a pozostałe wiązanie zajmuje łańcuch R lub boczny każdego aminokwasu.
W przypadku tyrozyny grupa ta składa się z pierścienia aromatycznego związanego z grupą hydroksylową (OH), która nadaje mu zdolność do tworzenia mostów wodorowych z innymi cząsteczkami i co daje mu istotne cechy funkcjonalne dla niektórych enzymów.
Może ci służyć: baroreceptoryFunkcje
Tyrozyna jest fundamentalnym składnikiem wielu białek o dużej różnorodności działań biologicznych i funkcji.
U ludzi i innych ssaków ten aminokwas jest wykorzystywany w tkankach nerwowych i nerkowych do syntezy dopaminy, adrenaliny i noradrenaliny, trzech neuroprzekaźników związanych z katecholaminergią związaną z najwyższym znaczeniem dla organizowania ciała.
Jest również niezbędny do syntezy ochraniaczy promieniowania ultrafioletowego (UV), takich jak melanina; niektórych środków przeciwbólowych, takich jak endorfiny i cząsteczki przeciwutleniacze, takie jak witamina E.
Podobnie, ten aminokwas służy do syntezy hormonów tiraminy, ośmiornicy i tarczycy poprzez organizację jodu w reszcie tyrozyn.
Tiramina jest cząsteczką wazoaktywną występującą w ludzkim ciele, a ośmiokrotnie jest aminą związaną z noreprenaliną.
Wszystkie te funkcje tyrozyny są możliwe dzięki jej uzyskaniu z białek diety lub przez hydroksylację fenyloalaniny z wątrobą jako główny układ podaży ogólnoustrojowej wspomnianego aminokwasowego.
Funkcje w roślinach
Tyrozyna i niektóre pośredniki wygenerowane podczas ich biosyntezy karmią biosyntetyczne trasy metabolitów specjalizujących się w obronie, w przyciąganiu zapylaczy, w transporcie elektronicznym i wsparciu strukturalnym.
Biosynteza
W ludzkiej istocie tyrozyna jest uzyskiwana z diety lub syntetyzowana w jednym etapie komórek wątroby z fenyloalaniny, niezbędnego aminokwasu, poprzez reakcję katalizowaną przez kompleks enzymatyczny hydroksylazy fenyloalaniny.
Ten kompleks ma aktywność tlenową i jest obecny tylko w wątrobie ludzi lub innych ssaków. Reakcja syntezy tyrozyny implikuje zatem przeniesienie atomu tlenu do pozycji Do aromatyczny pierścień fenyloalaniny.
Ta reakcja występuje w tym samym czasie, gdy cząsteczka wody powstaje z powodu zmniejszenia innego atomu tlenu cząsteczkowego, a moc zmniejszającej wkłada się bezpośrednio przez NADPH sprzężoną z cząsteczką tetrahydropterinową, która jest podobna do kwasu foliowego, która jest podobna do kwasu foliowego.
Biosynteza w roślinach
W roślinach tyrozyna jest syntetyzowana Novo poniżej trasy „shikimato”, która karmią inne biosyntetyczne trasy innych aromatycznych aminokwasów, takich jak fenyloalanina i tryptofan.
W tych organizmach synteza opiera się na związku zwanym „corismato”, który jest końcowym produktem trasy Shikimato, a ponadto wspólny prekursor dla wszystkich aromatycznych aminokwasów, niektórych witamin i hormonów roślinnych.
Koryzm jest przekształcany w przedmowę przez katalityczne działanie enzymu koryzmatu Mutasa i jest to pierwszy „zaangażowany” etap w syntezie tyrozyny i fenyloalaniny w roślinach.
Prenenian jest przekształcany w tyrozynę przez dekarboksylację oksydacyjną i transaminację, która może wystąpić w dowolnej kolejności.
W jednej z dróg biosyntetycznych etapy te można katalizować przez specyficzne enzymy znane jako dehydrogenaza specyficzna dla prefenianu (PDH) (która przekształca przedmowę w 4-hydroksyfenylistylopiroguwan (HPP)) i aminotransferazę tyrozyny ( odpowiednio.
Inna ścieżka syntezy tyrozyny z przedmowy implikuje transaminację predenenianu do nieproteinogennego aminokwasu zwanego L-arogenenianem, katalizowaną przez enzym aminotransferazę przed.
L-arogenian L podlega następnie oksydacyjnej dekarboksylacji z tworzeniem tyroksyny, reakcji ukierunkowanej przez enzymu dehydrogenazy specyficznej dla arogeneanu tyrozyny, znanej również jako ADH.
Rośliny preferencyjnie używają trasy arenatu, podczas gdy większość drobnoustrojów syntetyzuje tyrozynę z HPP pochodzącej z predenesatu.
Rozporządzenie
Jak to jest prawda w przypadku większości biosyntetycznych dróg aminokwasów, rośliny mają ścisły układ regulacji syntezy aromatycznych aminokwasów, w tym tyrozyny.
Może ci służyć: pyszny potwór: cechy, siedlisko, opieka, właściwościW tych organizmach regulacja występuje na wielu poziomach, ponieważ mechanizmy kontrolujące trasę Shikimato kontrolują również produkcję tyrozyny, trasę, dla której istnieją również ich własne mechanizmy regulacji.
Jednak wymagania tyrozyny, a zatem sztywność w regulacji ich biosyntezy, są specyficzne dla każdego gatunku rośliny.
Degradacja
Degradacja lub katabolizm tyrozyny powoduje tworzenie fumaranu i acetooctanu. Pierwszy etap tej trasy polega na konwersji aminokwasu na 4-hydroksyfenylopypypan przez enzym cytozolowy znany jako aminotransferaza tyrozyna.
Ten aminokwas może być również transaminowany w mitochondriach hepatocytów przez enzym asparaginian aminotransferazy, chociaż enzym ten nie jest bardzo ważny w normalnych warunkach fizjologicznych.
Poprzez degradację tyrozyny może wystąpić sukcynyloococtan, który można dekarboksylować do figantyczny. Aoctan sukcynylo-akcja jest najpotężniejszym inhibitorem enzymu odpowiedzialnym za syntezę grupy hemo, dehydratazę kwasu kwasu 5-aminolewinowego.
Synteza adrenaliny i noradrenaliny
Jak wspomniano, tyrozyna jest jednym z głównych substratów do syntezy dwóch bardzo ważnych neuroprzekaźników dla ludzkiego ciała: adrenaliny i noradrenaliny.
Jest to początkowo stosowane przez enzym znany jako hydroksylaza tyrozyna, zdolna do dodania dodatkowej grupy hydroksylowej do aromatycznego pierścienia grupy Ri tyrozyny R, która tworzy związek znany jako dopa.
Dopa powoduje, że dopamina po enzymatycznie przetwarzana przez enzym Dopa Decboxilas.
Dopamina jest następnie przekształcana w noreprenalinę przez działanie enzymu dopaminy β -oksydazy, który katalizuje dodanie grupy hydroksylowej do -ch, która była częścią grupy R tyrozyny i który działał jako „most” między aromatycznym pierścieniem i węgiel α.
Adrenalina wywodzi się z noradrenaliny przez działanie fenytanoloaminy N-metylotransferaza, która jest odpowiedzialna za zależne od S-adenozylo-metenina przeniesienia grupy metylowej (-ch3) do grupy wolnej aminowej noradrenaliny.
Pokarmy bogate w tyrozynę
Jak wspomniano powyżej, tyrozyna jest niezbędnym „warunkowo” aminokwasem, ponieważ jest syntetyzowana w ludzkim ciele przez hydroksylację fenyloalaniny, niezbędnego aminokwasu.
Dlatego, jeśli spożycie fenyloalaniny pokrywa wymagania ciała, tyrozyna nie jest czynnikiem ograniczającym normalne funkcjonowanie komórek. Jednak tyrozyna jest również nabywana z białek spożywanych z codzienną żywnością.
Niektóre badania podają, że minimalne dzienne spożycie zarówno tyrozyny, jak i fenyloalaniny powinno wynosić od 25 do 30 mg na kilogram masy, więc przeciętna osoba powinna spożywać więcej lub mniej 875 mg tyrozyny dziennie.
Pokarmy o wyższej zawartości tyrozyny to ser i soja. Wśród nich są także wołowina, jagnięcy, wieprzowina, kurczak i ryby.
Niektóre nasiona i orzechy, takie jak orzechy, również nadają znaczący wkład z tego aminokwasu, a także jaja, produktów mlecznych, ziarna i zbóż.
Korzyści z Twojego spożycia
Tyrozyna jest powszechnie spożywana w postaci suplementów dietetycznych lub odżywczych, szczególnie w leczeniu patologii znanej jako fenylocetonuria, cierpiących przez pacjentów niezdolnych do prawidłowego przetworzenia fenyloalaniny i dlatego nie wytwarzają tyrozyny.
Może ci służyć: funkcja relacjiUważa się, że wzrost ilości spożywanej tyrozyny może poprawić funkcje poznawcze związane z uczeniem się, pamięcią i stanem ostrzegawczym w stresujących warunkach, ponieważ jej katabolizm jest związany z syntezą adrenaliny i neurotransmiterów noradonsynowych.
Niektóre osoby biorą tabletki na tiozynę, aby pozostać czujnym w ciągu dnia, jeśli stracili znaczną ilość godzin snu.
Ponieważ ten aminokwas uczestniczy w tworzeniu hormonu tarczycy, jego zużycie może mieć pozytywny wpływ na ogólnoustrojową regulację metaboliczną.
Zaburzenia niedoboru
Albinizm i alcaptonuria to dwie patologie związane z metabolizmem tyrozyny. Pierwszy warunek jest związany z wadliwą syntezą melaniny z tyrozyny, a drugi ma związek z defektami degradacji tyrozyny.
Albinizm charakteryzuje się brakiem pigmentacji w skórze, to znaczy pacjenci, którzy cierpią na nią, mają białe włosy i różowawą skórę, ponieważ melanina jest pigmentem odpowiedzialnym za zapewnienie koloru tym strukturom.
Ta patologia ma związek z niedoborem specyficznej tyrozynazy melanocytów, która jest odpowiedzialna za przekształcenie tyrozyny w dopa-kwinon, pośrednik w syntezie melaniny.
Objawy alcaptonurii są widoczne jako przesadna pigmentacja moczu (ciemność) i późne zapalenie stawów.
Inne patologie metaboliczne
Ponadto istnieją inne zaburzenia związane z metabolizmem tyrozyny, w tym:
- Dziedziczna tyrozinemia typu I: charakteryzująca się postępującą zwyrodnieniem wątroby i dysfunkcją nerek
- Dziedziczna tyrozinemia zespołu typu II lub Richnera-Hanharta: co jest widoczne jako zapalenie rogówki i zmiany ampularne w dłoniach i podeszwy stóp
- Tylozynemia typu III: która może być bezobjawowa lub obecna jako opóźnienia mentalne
- „Hawkinsinuria”: charakteryzujący się kwasicą metaboliczną w dzieciństwie i niezdolnością do prosperowania w rozwoju
Istnieją również inne wrodzone defekty metabolizmu metrozyny, które mają związek z niedoborami enzymów odpowiedzialnych za ich degradację, takie jak hydroksylaza tyrozyna, odpowiedzialna za pierwszy etap syntezy dopaminy z tyrozyny.
Bibliografia
- Aders Plimmer, r. (1908). Konstytucja chemiczna białek. wyszedłem. Londyn, Wielka Brytania: Longmans, Green i Co.
- Chakrapani, a., Gissen, s. 1., I McKiernan, P. (2012). Zaburzenia metabolizmu tyrozyny. W Wrodzony metaboliczny pożądanie: diagnoza i leczenie (PP. 265-276).
- Kretchmer, n., Levine, s., McNamara, godz., & Barnett, H. (1956). Pewne aspekty metabolizmu tyrozyny u młodych. Siema. Rozwój systemu utleniania tyrozyny w ludzkiej wątrobie. Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, ur., Zannoni, v., Laster, l., & Seegmiller, E. (1958). Charakter wady metabolizmu tyrozyny w Alkaptonurii. Journal of Biological Chemistry, 230, 251-260.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Nelson, zm. L., & Cox, m. M. (2009). Zasady biochemii lehninger. Omega Editions (Ed.).
- Schenck, c. DO., & Maeda, H. DO. (2018). Biosynteza tyrozyny, metabolizm i katabolizm w roślinach. Fitochemia, 149, 82-102.
- Slomiński, a., Zmijewski, m. DO., & Paweley, J. (2012). L-tyrozyna i L-dihydroksyfenyloalanina jako hormonalne regulatory funkcji melanocytów. Badania komórek pigmentowych i czerniaka, 25(1), 14-27.
- Van de, g. (2018). Linia zdrowia. Pobrano 16 września 2019 r. Z WWW.LILINE.com
- MD Web. (N.D.). Pobrano 15 września 2019 r. Z WWW.Webmd.com
- Whitbread, zm. (2019). Moje dane dotyczące żywności. Pobrano 15 września 2019 r. Z WWW.MyFooddata.com

