Termochemia

- 627
- 170
- Pani Gilbert Stolarczyk
Wyjaśniamy, że to termochemia, jakie badania, jej prawa i zastosowania
 W termochemii modyfikacje ciepła są badane w reakcjach chemicznych
W termochemii modyfikacje ciepła są badane w reakcjach chemicznych Co to jest termochemia?
Termochemia Odpowiada za badanie modyfikacji ciepła przeprowadzanych w reakcjach między dwoma lub więcej gatunkami chemicznymi. Jest uważany za istotną część termodynamiki, która bada transformację ciepła i innych rodzajów energii w celu zrozumienia kierunku opracowywania procesów i sposobu różnicego się jego energii.
Konieczne jest również zrozumienie, że ciepło wiąże się z przenoszeniem energii cieplnej, która występuje między dwoma ciałami, gdy są one w różnych temperaturach; Podczas gdy energia cieplna jest związana z losowym ruchem, jaki posiadają atomy i cząsteczki.
Dlatego, ponieważ prawie wszystkie reakcje chemiczne energia jest wchłaniana lub uwalniana przez ciepło, analiza zjawisk występujących w termochemii jest bardzo istotna.
Jakie badania termochemia?
Termochemia bada zmiany ciepła w postaci ciepła występujące w reakcjach chemicznych lub gdy zachodzą procesy sugerujące transformacje fizyczne.
W tym sensie pewne pojęcia należy wyjaśnić w temacie, aby lepiej zrozumieć.
System
Na przykład termin „system” odnosi się do konkretnego segmentu badanego wszechświata, rozumianego jako „wszechświata” rozważania systemu i jego otoczenia (wszystko zewnętrzne)).
Tak więc system składa się ogólnie z gatunków zaangażowanych w transformacje chemiczne lub fizyczne występujące w reakcjach. Systemy te można podzielić na trzy typy: otwarte, zamknięte i izolowane:
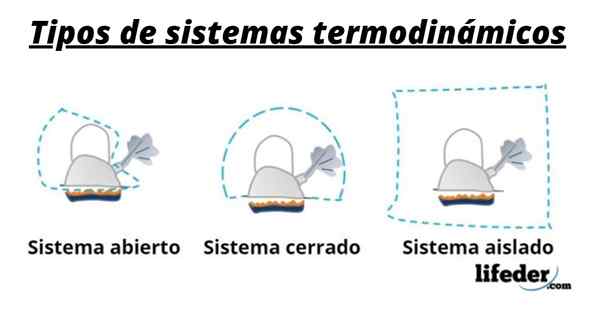
- Otwarty system to taki, który umożliwia przenoszenie materii i energii (ciepła) z otoczeniem.
- W zamkniętym systemie jest wymiana energii, ale nie ma materii.
- W izolowanym układzie przeniesienie materii lub energii w postaci ciepła nie jest prezentowane. Systemy te są również znane jako „adiabatyczne”.
Przepisy dotyczące termochemii
 Germain Hess, twórca prawa Hessa, fundamentalne dla termochemii
Germain Hess, twórca prawa Hessa, fundamentalne dla termochemii Prawa termochemii są ściśle powiązane z prawem Laplace'a i Lavoisiera, a także prawem Hessa, które są prekursorami pierwszego prawa termodynamiki.
Zasada określona przez francuskiego Antoine Lavoisier (ważny chemiczny i szlachetny) i Pierre-Simon Laplace (słynny matematyk, fizyczny i astronom) dokonuje przeglądu, że „zmiana energii, która przejawia się w każdej transformacji fizycznej lub chemicznej, ma takie samo i znaczące wielkość sprzeczna ze zmianami energii reakcji odwrotnej ”.
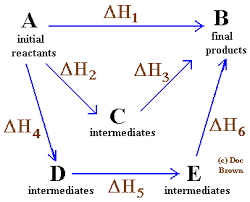
Hess Law
 Prosty i ogólny schemat, w którym stosuje się prawo Hessa dla czterech reakcji chemicznych
Prosty i ogólny schemat, w którym stosuje się prawo Hessa dla czterech reakcji chemicznych W tej samej kolejności pomysłów prawo sformułowane przez rosyjskiego chemika ze Szwajcarii, Germain Hess, jest kamieniem węgielnym wyjaśnienia termochemii.
Zasada ta opiera się na interpretacji prawa ochrony energii, która odnosi się do faktu, że energii nie można stworzyć ani zniszczyć, a jedynie przekształcona.
Prawo Hessa można w ten sposób ogłosić: „Całkowita entalpia w reakcji chemicznej jest taka sama, czy reakcja jest przeprowadzana w jednym kroku, jakby nastąpiła w sekwencji kilku kroków”.
Całkowita entalpia występuje jako odjęcie między sumą entalpii produktów, z wyjątkiem sumy entalpii reagentów.
W przypadku zmiany standardowej entalpii układu (w standardowych warunkach 25 ° C i 1 atm) można go schematyzować zgodnie z następującą reakcją:
Może ci służyć: kwas chlorogenowyΔHreakcja = ΣδH(produkty) - ΣδH(Reaganty)
Innym sposobem wyjaśnienia tej zasady, wiedząc, że zmiana entalpii odnosi się do zmiany ciepła w reakcjach, gdy są one podane do stałego presji, jest stwierdzenie, że zmiana entalpii netto systemu nie zależy od ścieżki, która następuje między stanem początkowym a końcem.
Pierwsze prawo termodynamiki
To prawo jest tak wewnętrznie powiązane z termochemią, że czasami jest zdezorientowane, które inspirowało drugiego; Tak więc, aby dać światła na to prawo, trzeba zacząć od stwierdzenia, że ma ono również swoje korzenie w zasadzie oszczędzania energii.
Tak, że termodynamika nie tylko bierze pod uwagę ciepło jako formę transferu energii (takiej jak termochemia), ale także obejmuje inne formy energii, takie jak energia wewnętrzna (LUB).
Tak więc zmienność energii wewnętrznej układu (δu) wynika z różnicy między jego stanami początkowymi i końcowymi (jak widać w prawie Hess).
Biorąc pod uwagę, że energia wewnętrzna składa się z energii kinetycznej (ruch cząstek) i energii potencjalnej (interakcje między cząsteczkami) tego samego układu, można wywnioskować, że istnieją inne czynniki, które przyczyniają się do badania stanu i właściwości każdego systemu.
Zastosowania termochemii
Termochemia ma wiele zastosowań, niektóre z nich zostaną wymienione poniżej:
- Określenie zmian energii w niektórych reakcjach poprzez zastosowanie kalorymetrii (pomiar zmian ciepła w niektórych izolowanych układach).
- Odliczenie zmian entalpii w systemie, nawet jeśli nie można ich znać z bezpośredniego pomiaru.
- Analiza transferów cieplnych wytwarzanych eksperymentalnie, gdy powstają związki organetaliczne z metali przejściowych.
- Badanie transformacji energetycznych (w cieple) podawanych w związkach koordynacji poliamin z metali.
- Określenie entalpii łącza metal-tlenu β-DICS i β-DICS zjednoczonych z metali.
- Podobnie jak w poprzednich zastosowaniach, termochemia może być użyta do określenia dużej liczby parametrów powiązanych z innymi rodzajami funkcji energii lub stanu, które są tymi, które definiują status systemu w danym momencie.
- Termochemia jest również stosowana w badaniu wielu właściwości złożonych, jak w kalorymetrii miareczkowania.
Bibliografia
- Wikipedia. (S.F.). Termochemia. Odzyskane z.Wikipedia.org
- Chang, R. (2007). Chemia, dziewiąta edycja. Meksyk: McGraw-Hill.
- Librettexts. (S.F.). Termochemia - przegląd. Uzyskane z Chem.Librettexts.org
- Tyagi, s. 1. (2006). Termochemia. Odzyskane z książek.Google.współ.Iść
- Ribeiro, m. DO. (2012). Termochemia i jej zastosowania w systemach chemicznych i biochemicznych. Uzyskane z książek.Google.współ.Iść
- Singh, n. B., Das, s. S., I Singh,. K. (2009). Chemia fizyczna, tom 2. Odzyskane z książek.Google.współ.Iść

