Systemy teorii kolizji, energia, przykłady
- 2318
- 460
- Maksymilian Kępa
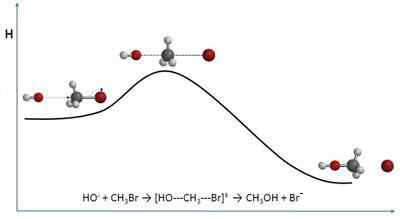
Teoria zderzenia Wyjaśnij prędkości reakcji chemicznych z perspektywy molekularnej. Jest zatem blisko kinetyki chemicznej. Zamiast zbliżać się do prędkości pod względem stężeń, w oparciu o częstotliwości kolizji.
Mówiąc o zderzeniach, wizerunek niektórych piłek bilardowych może przychodzić mi na myśl, wpływając na siebie na stole. Jednak cząsteczki, chociaż teoria ta zakłada, że jej formy są sferyczne, nie zachowują się podobnie. Zderzenia molekularne różnią się na kilka sposobów, zarówno przestrzenne, jak i energetyczne.

Teoria ta, chociaż może być nieco złożona matematycznie i pokazuje znaczne odmiany dotyczące wyników eksperymentalnych, oferuje obraz widzialnych interpretacji i bez abstrakcyjnych aspektów.
Chociaż stosuje się go do układów gazowych lub bardzo rozcieńczonych, jego zasady mogą rozciągać się na dowolną reakcję i podłoże fizyczne.
[TOC]
Warunki wystąpienia reakcji
Zgodnie z teorią kolizji istnieją trzy warunki, aby zareagować reakcje:
- Gatunki chemiczne (jony, cząsteczki, rodniki itp.) Muszą efektywnie zderzyć.
- Muszą nosić wystarczającą energię do rozpadu swoich linków.
- Ponadto orientacja wpływu musi być bardzo konkretna.
Zderzenia molekularne
 Podobnie jak w kręgle, reakcje odbywają się tylko wtedy, gdy pojawiają się efektywne zderzenia pod względem energii i wskazówek
Podobnie jak w kręgle, reakcje odbywają się tylko wtedy, gdy pojawiają się efektywne zderzenia pod względem energii i wskazówek Zderzenia molekularne mają coś wspólnego z makroskopowym: występują głównie między dwoma gatunkami lub ciałami. Dwie bilardowe kulki zderzają się ze sobą, a także piłka nożna o ścianę lub dwa pociski na środku powietrza. To znaczy kolizje w odniesieniu do chemii i jej reakcji są typu bimolekularnego.
Może ci służyć: jonizacja w fizyce i chemii: koncepcja, proces i przykładyCząsteczki nie są nieruchome, ale poruszają się i obracają w otaczającej ich przestrzeni. W ten sposób zakłada się, że rysują rodzaj koła zwanego przekroju, na którym istnieje prawdopodobieństwo, że inna cząsteczka Colison. Podobnie teoria uważa, że cząsteczki są kuliste w celu uproszczenia modeli matematycznych.
Dwie cząsteczki, hipotetycznie sferyczne, mogą bez problemu zderzyć się, nawet jeśli nie ma reakcji chemicznej. Ale nie zdarza się to w ten sam sposób, jeśli chodzi o trzy, cztery lub więcej cząsteczek.
Im więcej gatunków powinni zderzyć się, aby powstać produkt, tym bardziej mało prawdopodobne staje się zjawisko. Wyjaśnia to wizualnie, próbując jednocześnie trzy piłki lub pociski. Dlatego zderzenia bimolekularne są zdecydowanie najczęstsze.
Systemy
Teoria kolizji jest ważna tylko dla systemów lub faz oprogramowania. Wynika to z faktu, że gazy wykazują zachowanie, które mogą być dobrze opisane przez ich kinetykę.
W przypadku fazy ciekłej lub bardzo rozcieńczonych roztworów, gatunki reaktywne są owinięte w klatkę cząsteczek rozpuszczalnika, z którymi również zderzają się. To modyfikuje panoramę, ponieważ reakcje nie tylko zależą od częstotliwości kolizji, ale także od dyfuzji cząsteczek reagenta przez średni.
Energie kolizji
Cząsteczki mogą zderzyć się powoli lub bardzo szybko. To zależy od tego, jak duża jego energia, co z kolei zmienia się znacznie w zależności od temperatury. Im silniejsze zderzenie, prawdopodobieństwo, że istnieje reakcja chemiczna, ponieważ energia ta może złamać niezbędne linki do tworzenia nowych.
Może ci służyć: monomeryTa energia jest znana jako aktywacja iDO, I jest charakterystyczny dla każdej reakcji chemicznej. Gdy temperatura wzrasta, średnia cząsteczek jest w stanie dopasować lub przekraczać EDO, Tak więc liczba skutecznych zderzeń, a zatem utworzone produkty, rosną.
W obecności katalizatora iDO zmniejsza się, ponieważ zapewnia powierzchnie i elektroniczne środki, które kolizje korzyści. Wynik: szybkość reakcji wzrasta, bez zwiększania temperatury lub dodawania innych odczynników.
Czynnik steryczny
Gatunki chemiczne skutecznie zderzają się, aby reagować, przewidując tę teorię, jaka będzie szybkość ich reakcji. Jednak eksperymenty wykazały, że im bardziej złożone struktury odczynników, tym większe odchylenia lub różnice między prędkościami teoretycznymi i eksperymentalnymi.
Wynika to z faktu, że cząsteczki są dalekie od sferycznych, ale przestrzennie mają wszelkiego rodzaju geometrię. Tutaj wchodzi czynnik steryczny, ρ, z którym stara się skorygować prędkości reakcji, aby prognozy teorii z wynikami eksperymentalnymi były lepsze.
Przykłady reakcji
Reakcja bimolekularna
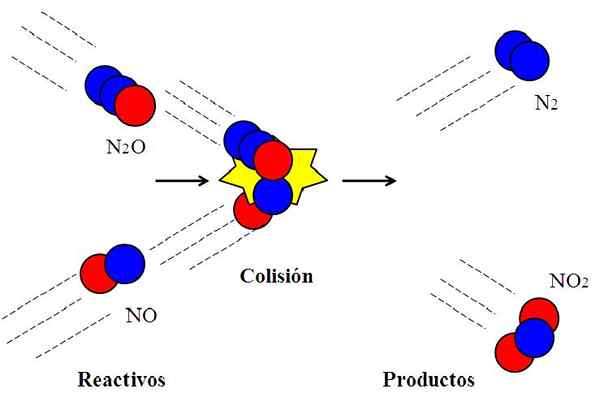 Skuteczne zderzenie między tlenkami azotu. Źródło: Gabriel Bolívar.
Skuteczne zderzenie między tlenkami azotu. Źródło: Gabriel Bolívar. Następująca reakcja:
N2O + no → n2 + NIE2
Jest powszechnie stosowany do wyjaśnienia, co oznacza skuteczna orientacja w zderzeniach molekularnych.
Cząsteczka n2Lub, tlenek dyitrogenu, nie będzie reagował z nr, tlenek azotu, chyba że podczas zderzenia atom tlenu (czerwony koło) n2Lub wstrząs bezpośrednio atomem azotu (niebieskie koło) NO. Tylko w ten sposób produkty n będą pochodzą2 i nie2; W przeciwnym razie n cząsteczki2O i nie odbijają się bez reagowania.
Może ci służyć: stan gazowy: cechy, prawo ogólne, przykładyTo jest przykład kolizji bimolekularnej dla elementarnej reakcji bimolekularnej. Nawet gdy odczynniki mają wystarczającą energię, aby rozbić łącza, jeśli orientacja nie jest odpowiednia, nie będzie reakcji chemicznej.
Reakcja jednorolekularna
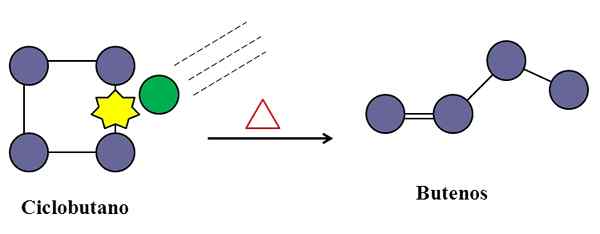 Kolizje są również niezbędne do izomeryzacji cyklobutanu. Źródło: Gabriel Bolívar.
Kolizje są również niezbędne do izomeryzacji cyklobutanu. Źródło: Gabriel Bolívar. W jednoromolekularnej reakcji elementarnej kolizje molekularne mogą również interweniować, nawet jeśli jest to tylko gatunek, który cierpi transformacja lub rozkład jego powiązań.
Rozważmy na przykład izomeryzację cyklobutanu, aby wywołać mieszankę butanów. Gdy temperatura wzrośnie, cząsteczki cyklobutanu będą wibrowały przy wyższych częstotliwościach i zderzają się z większą siłą. Produkty pokazują jednak, że dwie cząsteczki cyklobutanu nie reagują na siebie, ponieważ inaczej wytworzyłyby związek z ośmioma węgliami.
Pośrodku mogą istnieć zanieczyszczenia (zielone koło), które również zderzają się z cyklobutanem, szczególnie na dowolnym z jego linków C-C. Mogą to być szlachetne gazy lub niezbyt reaktywne cząsteczki, takie jak azot.
Nadejdzie czas, gdy zanieczyszczenie zderzy się z wystarczającą energią, aby złamać jedno z linków C-C cyklobutanu. A następnie jej cząsteczka będzie starała się zmieniać i rozpocząć butelen, rozpoznawalny ze względu na podwójne wiązanie i strukturę łańcucha liniowego.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Glasstone. (1970). Traktat fizykochemii. Aguilar s. DO. z Editions, Juan Bravo, 38, Madryt (Hiszpania).
- Walter J. Moore. (1962). Chemia fizyczna. (Czwarta edycja). Longmans.
- Wikipedia. (2020). Teoria zderzenia. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (2020). Teoria zderzenia. Britannica Encyclopaedia. Odzyskane z: Britannica.com
- Clark Jim. (2018). Teoria kolcy szybkości reakcji. Odzyskane z: chemguide.współ.Wielka Brytania
- Lawson p. I niższe s. (18 maja 2020). Teoria kolizji. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Charakterystyka tekstu dydaktycznego, struktura, typy i przykłady
- Kraje i cechy wyspiarskie lub antyllesowe »

