Historia teorii kinetycznej molekularnej, postulatów i przykładów

- 2532
- 208
- Gabriela Łuczak
Teoria kinetyczna molekularna Jest to taki, który ma na celu wyjaśnienie eksperymentalnych obserwacji gazów z mikroskopowej perspektywy. Oznacza to, że próbuje powiązać naturę i zachowanie cząstek gazowych, z fizycznymi cechami gazu jako płynu; Wyjaśnij makroskopowe z mikroskopowego.
Gazy zawsze były przedmiotem zainteresowania naukowców ze względu na ich nieruchomości. Zajmują całą objętość pojemnika, w jakim są, będąc w stanie całkowicie kompresować bez ich treści przeciwnej niższej oporu; A jeśli temperatura wzrośnie, pojemnik zaczyna się rozwijać, a nawet może pękać.
 Cząsteczki gazowe w odległych warunkach lub zbliżone do upłynnienia. Źródło: Olivier Cleynen i użytkownik: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Cząsteczki gazowe w odległych warunkach lub zbliżone do upłynnienia. Źródło: Olivier Cleynen i użytkownik: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Wiele z tych właściwości i zachowań jest podsumowanych w prawie gazów idealnych. Uważają jednak gaz za całość, a nie jako zestaw milionów rozproszonych cząstek w przestrzeni; Ponadto nie dostarcza danych ciśnienia, objętości i temperatury, więcej informacji o tym, jak poruszają się te cząsteczki.
Tak jest tak, że teoria kinetyczna molekularna (TCM) proponuje je wizualizować jako mobilne kule (obraz doskonały). Te kule zderzają się ze sobą i ścianami arbitralnie i utrzymują trajektorię liniową. Jednak gdy temperatura maleje i wzrasta ciśnienie, trajektoria kulek staje się krzywa.
Gaz, według TCM, musi zachowywać się jak kule pierwszego pola obrazu. Ale po ochłodzeniu i zwiększeniu na nich presji, ich zachowanie odsuwa się od ideału. Są to wtedy prawdziwe gazy, zbliżone do upłynnienia i idą do fazy ciekłej.
W tych warunkach interakcje między kulkami stają się ważniejsze, do tego stopnia, że ich prędkości na chwilę powolne. Im bliżej są upłynnienie, tym więcej krzywych stają się ich trajektorie (prawe skrzynka), a.
[TOC]
Historia
Daniel Bernoulli
Idea tych sfer, lepiej nazywanych atomami, była już rozpatrywana przez filozof rzymski Lukrecjusz; Nie dla gazów, ale dla stałych, statycznych przedmiotów. Z drugiej strony, w 1738 r. Daniel Bernoulli zastosował widzenie atomowe do gazów i cieczy, wyobrażając je jako nieuporządkowane kule poruszające się we wszystkich kierunkach.
Jego praca jednak naruszyła w tym czasie prawa fizyki; Ciało nie mogło poruszać się wiecznie, więc nie można było myśleć, że zestaw atomów i cząsteczek zderzył się ze sobą bez utraty energii; to znaczy istnienie elastycznych zderzeń nie było możliwe.
Rudolf Clausius
Sto lat później inni autorzy wzmocnili TCM modelem, w którym cząstki gazowe poruszały się w jednym kierunku. Rudolf Clausius jednak skompilował jego wyniki i uzbroił bardziej kompletny model TCM, z którym starał się wyjaśnić idealne prawa Gase wykazane przez Boyle, Charles, Dalton i Avogadro.
Może ci służyć: kulisetria: podstawy, typy, aplikacjeJames Clerk Maxwell i Ludwig Boltzmann
W 1859 r. James Clerk Maxwell stwierdził, że cząsteczki gazowe wykazują zakres prędkości w danej temperaturze i że ich zestaw można rozważyć za pomocą średniej prędkości molekularnej.
Następnie, w 1871 r.
Postuluj teorię kinetyczną molekularną
Aby rozważyć gaz z jego cząstek, spełniony jest model, w którym spełnione są pewne postulaty lub założenia; postulowany, że logicznie powinien być w stanie przewidzieć i wyjaśniać (tak wierne, jak to możliwe) obserwacje makroskopowe i eksperymentalne. To powiedziawszy, postulaty TCM są wymienione i opisane.
Objętość cząstek gazowych jest nieistotna
W pojemniku pełnym cząstek gazowych rozpraszają się i odsuwają między nimi przez wszystkie zakręty. Gdyby przez chwilę mogli się spotkać w określonym punkcie pojemnika, bez upłynnienia, można by zaobserwować, że ledwo zajmują nikczemną część objętości pojemnika.
Oznacza to, że w pojemniku, nawet jeśli zawiera miliony cząstek gazowych, jest naprawdę bardziej pusty niż pełny (stosunek objętości-vacío znacznie mniejszy niż 1); Dlatego jeśli jego bariery na to pozwalają, on i gaz w środku mogą być nagle ściskane; Ponieważ w odpowiedzi na cząsteczki są bardzo małe, podobnie jak ich objętość.
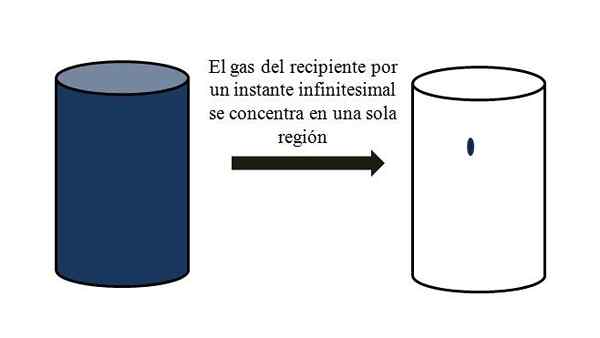 Zależność głośności gazu w pojemniku. Źródło: Gabriel Bolívar.
Zależność głośności gazu w pojemniku. Źródło: Gabriel Bolívar. Najwyższy obraz precyzyjnie ilustruje to, co skomentowano powyżej, przy użyciu niebieskawego gazu.
Siły przyciągania między cząsteczkami są zerowe
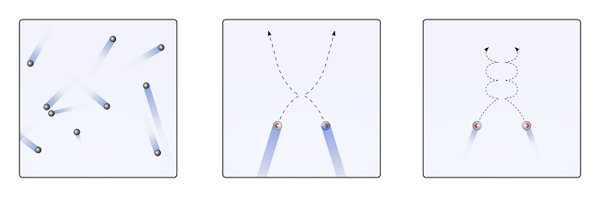
Cząstki gazowe wewnątrz pojemnika zderzają się ze sobą bez wystarczającego czasu, aby ich interakcje stały się siłą; Jeszcze mniej, gdy to, co ich głównie otacza, jest molekularne puste. Bezpośrednim konsekwencją jest to, że ich liniowe trajektorie pozwalają im całkowicie pokryć objętość pojemnika.
Gdyby powyższe nie były tak, „dziwaczny” i „labiryntowy” pojemnik miałby mokre regiony w wyniku kondensacji gazowej; Zamiast tego cząsteczki przemieszczają cały pojemnik z pełną swobodą, bez siły ich interakcji, zatrzymywanie ich.
Może ci służyć: kwas chlorowy (HCLO3) Wywłaszczenia cząstek gazowych, gdy interakcje są zerowe lub nieistotne (do., liniowe), a kiedy są ważne (b., Krzywe). Źródło: Gabriel Bolívar.
Wywłaszczenia cząstek gazowych, gdy interakcje są zerowe lub nieistotne (do., liniowe), a kiedy są ważne (b., Krzywe). Źródło: Gabriel Bolívar. Liniowe trajektorie górnego obrazu (a.) zademonstruj ten postulat; Podczas gdy trajektorie są krzywe (b.), dowody, że istnieją interakcje, których nie można zignorować wśród cząstek.
Cząstki gazowe są zawsze w ruchu
Z pierwszych dwóch postulatów zbiegają się, a także fakt, że cząstki gazowe nigdy nie przestają się poruszać. Po zamazaniu w pojemniku zderzają się ze sobą i ze ścianami tego samego, z siłą i prędkością bezpośrednio proporcjonalną do temperatury bezwzględnej; Ta siła jest ciśnieniem.
Gdyby cząsteczki gazowe przestaną poruszać się chwilą, będą świadkami w „językach dymu”, wynikającym z niczego, z wystarczającą ilością czasu, aby zamówić się w próżni i dać losowe sposoby.
Zderzenia między cząsteczkami a ścianami pojemnika są sprężyste
Jeśli elastyczne zderzenia między cząstkami gazowymi a ścianami pojemnika nigdy nie wystąpią w pojemniku, nigdy nie nastąpi (podczas gdy warunki fizyczne nie zmienią) kondensacja gazu; lub co to samo, co powiedzenie, że nigdy nie odpoczywają i zawsze zderzają się.
Wynika to z faktu, że w elastycznych zderzeniach nie ma netto utraty energii kinetycznej; Cząstka zderza się ze ścianą i odbija się z tą samą prędkością. Jeśli cząstka, gdy zderzenie zmniejsza prędkość, druga przyspiesza, bez ciepła lub dźwięku, który rozprasza energię kinetyczną któregokolwiek z nich.
Energia kinetyczna nie pozostaje stała
Ruch cząstek jest losowy i chaotyczny, więc nie wszyscy niosą tę samą prędkość; Jak to się dzieje, na przykład na autostradzie lub w tłumie. Niektóre są bardziej energiczne i podróżują większą prędkością, podczas gdy inne są powolne, czekając na kolizję, aby je przyspieszyć.
Aby opisać swoją prędkość, konieczne jest obliczenie średniej; I dzięki temu uzyskuje się średnią energię kinetyczną cząstek lub cząsteczek gazowych. Ponieważ energia kinetyczna wszystkich cząstek stale się zmienia, średnia umożliwia lepszą kontrolę danych i możesz pracować z większą niezawodnością.
Średnia energia kinetyczna jest równa danej temperaturze dla wszystkich gazów
Średnia energia kinetyczna molekularna (ECposeł) W pojemniku jest modyfikowana temperaturą. W wyższej temperaturze energia ta będzie większa. Ponieważ jest to średnia, mogą istnieć cząstki lub soda, które mają większą lub mniejszą energię w odniesieniu do tej wartości; Niektóre odpowiednio szybciej i wolniejsze.
Może ci służyć: kwasy i zasady: różnice, cechy, przykładyMatematycznie można wykazać, że WEposeł Zależy to wyłącznie od temperatury. Oznacza to, że nie ma znaczenia, jakie gaz, jego masa cząsteczkowa lub struktura, jego ECposeł Będzie taki sam w temperaturze t i będzie się różnić tylko wtedy, gdy wzrośnie lub zmniejszy. Ze wszystkich postulatów być może jest to najbardziej istotne.
A co z średnią prędkością molekularną? W przeciwieństwie do ECposeł, Masa cząsteczkowa wpływa na prędkość. Im cięższa cząsteczka cząstki lub gazu, naturalne jest oczekiwanie, że będziesz się powoli poruszać.
Przykłady
Poniżej znajdują się krótkie przykłady, w jaki sposób TCM udało się wyjaśnienia prawom gazów idealnych. Chociaż nie są one rozwiązane, inne zjawiska, takie jak rozpowszechnianie i wysięk gazów, można również wyjaśnić TCM.
Boyle Law
Jeśli objętość pojemnika jest ściśnięta w stałej temperaturze, zmniejsza się odległość, którą cząsteczki gazowe muszą zderzyć się, aby zderzyć się ze ścianami; co jest równe wzrostowi częstotliwości tych zderzeń, co powoduje większe ciśnienie. Gdy temperatura jest stała, WEposeł Jest również stały.
Charles Law
Jeśli t, EC wzrastaposeł wzrośnie. Cząstki gazowe będą poruszać się szybciej i zderzają większą liczbę razy ze ścianami pojemnika; zwiększa ciśnienie.
Jeśli ściany są elastyczne, zdolne do rozszerzenia, jego obszar stanie się większy, a ciśnienie spadnie, aż stanie się stałe; W rezultacie objętość również wzrośnie.
Prawo Daltona
Gdyby dodano kilka litrów różnych gazów w przestronnym pojemniku, z mniejszych pojemników, ich całkowite ciśnienie wewnętrzne byłoby równe sumie ciśnień cząstkowych wywieranych przez każdy rodzaj gazu osobno.
Ponieważ? Ponieważ wszystkie gazy zaczynają się ze sobą zderzyć i rozpraszają jednorodnie; Interakcje między nimi są nieważne, a próżnia dominuje w pojemniku (postulaty TCM), więc jest tak, jakby każdy gaz został znaleziony sam, wywieranie jego ciśnienia w sposób indywidualnie bez zakłócenia innych gazów.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning, s. 426-431.
- Fernández Pablo. (2019). Teoria kinetyczna molekularna. Vix. Odzyskane z: Vix.com
- Jones, Andrew Zimmerman. (7 lutego 2019). Kinetyczna teoria molekularna gazów. Odzyskane z: Thoughtco.com
- Hall Nancy. (5 maja 2015 r.). Kinetyczna teoria gazów. Glenn Research Center. Źródło: GRC.garnek.Gov
- Blaber m. I niższe s. (9 października 2018 r.). Podstawy kinetycznej teorii molekularnej. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Kinetyczna teoria molekularna. Źródło: chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Kinetyczna teoria gazów. Źródło: w:.Wikipedia.org
- TOPPR. (S.F.). Kinetyczna teoria molekularna gazów. Odzyskane z: toppr.com

