Okresowa tabela elementów
- 1342
- 144
- Eugenia Czapla
Jaki jest okresowy tabelę elementów?
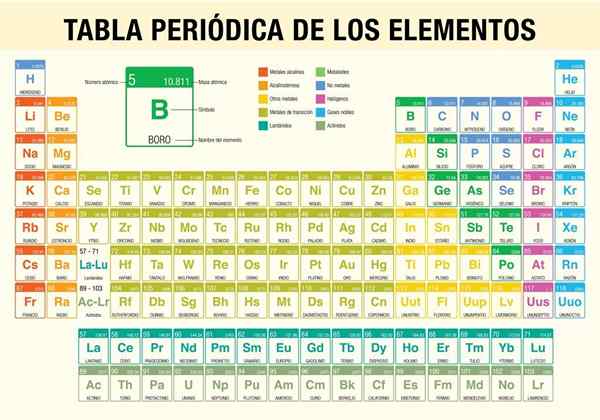
Okresowa tabela elementów Jest to narzędzie, które pozwala zapoznać się z właściwościami chemicznymi 118 znanych dotychczas. Jest niezbędny podczas wykonywania obliczeń stechiometrycznych, przewidywania właściwości fizycznych elementu, klasyfikując je i znajdując okresowe właściwości wśród nich.
Atomy stają się cięższe, gdy ich jądra dodają protony i neutrony, którym muszą również towarzyszyć nowe elektrony; W przeciwnym razie elektrooneTralność nie byłaby możliwa. Zatem niektóre atomy są bardzo lekkie, takie jak wodór i inne, superpesados, takie jak Oganerson.
To naukowiec Dmitri Mendeléyev, który w 1869 r. (Prawie 150 lat temu) opublikował, po dekadzie badań teoretycznych i eksperymentów, pierwsza okresowa tabela w celu zorganizowania 62 elementów znanych w tym czasie w tym czasie.
Jaka jest stół okresowy?
Główne zastosowania tabeli to:
- Poznaj symbol i nazwę każdego istniejącego elementu chemicznego.
- Poznaj masę atomową i liczbę atomową elementu.
- Informować o relacjach między różnymi elementami.
- Pokaż różne trendy (okresowość).
- Klasyfikacja rodzajów pierwiastków chemicznych. Te typy obejmują metale alkaliczne, podstawowe metale, metale przejściowe, nie -metalowe, szlachetne gazy, halogeny, ziemia alkaliczna, semimetale, aktyńki i lantanidy.
- Przewiduj właściwości nowych elementów, które jeszcze nie zostały odkryte lub nie zostały zsyntetyzowane.
Jak zorganizuje się okres okresowy? (Struktura i organizacja)
Okresy
Elementy są uporządkowane w rzędach lub okresach w zależności od poziomu energii jego orbitali. Przed okresem 4, kiedy elementy nastąpiły w rosnącym porządku masy atomowej, to właśnie na osiem z nich właściwości chemiczne powtórzono ponownie (prawo oktaw przez John Newlands).
Metale przejściowe zakradły się do innych elementów niemetalicznych, takich jak siarka i fosfor. Z tego powodu istotne było wprowadzenie fizyki kwantowej i konfiguracji elektronicznych do zrozumienia nowoczesnych tabel okresowych.
Orbitale warstwy energetycznej są wypełnione elektronami (i rdzeniami protonów i neutronów), ponieważ porusza się przez pewien czas. Ta warstwa energii idzie w parze z rozmiarem atomowym lub radiem; Dlatego elementy wyższych okresów są mniejsze niż te znalezione poniżej.
H i, które znalazłem na pierwszym poziomie (okresu) poziomu energii; Pierwszy rząd szarych skrzynek, w czwartym okresie; i rząd pól Ananjadas, w szóstym okresie. Zauważ, że chociaż ten ostatni wydaje się być w rzekomym dziewiątym okresie, w rzeczywistości należy do szóstego, tuż po żółtej skrzynce BA.
Grupy
Podróż po okresie polega na tym, że masa, liczba protonów i elektronów wzrasta. W tej samej kolumnie lub grupie, chociaż masa i protony się różnią, liczba Elektrony warstwy Valencia Jest taki sam.
Na przykład w pierwszej kolumnie lub grupie H ma tylko jeden elektron na orbicie 1s1, Jak Li (2s1), Sód (3s1), Potas (4s1) I tak dalej do Francio (7s1). Ta liczba 1 oznacza, że te elementy ledwo mają elektron Valencia, a zatem należą do grupy 1 (AI). Każdy element jest w różnych okresach.
Bez liczenia wodoru, zielonego pudełka, elementy pod nim pochodzą z pomarańczowych skrzynek i nazywane metali alkalicznych. Jeszcze jedno po prawej polu w dowolnym okresie jest grupa lub kolumna 2; Oznacza to, że jego elementy mają dwa elektrony walencyjne.
Może ci służyć: wydajność teoretycznaAle kiedy poruszasz się w prawo, bez wiedzy orbitali d, docieracie do grupy Boro (B) lub grupy 13 (iiia); Zamiast grupy 3 (iiib) lub Scandio (SC). Biorąc pod uwagę wypełnienie orbitali d, okresy szarego pudełka zaczynają się podróżować: metale przejściowe.
Liczby protonów vs elektrony Walencji
Podczas badania okresowej tabeli może pojawić się zamieszanie między liczbą atomową Z lub liczbą całkowitych protonów w jądrze, a ilością elektronów walencyjnych. Na przykład węgiel ma z = 6, to znaczy ma sześć protonów, a zatem sześć elektronów (w przeciwnym razie nie może to być atom z obciążeniem neutralnym).
Ale z tych sześciu elektronów, cztery pochodzą z Walencji. Z tego powodu jego konfiguracja elektroniczna wynosi [He] 2s22 p2. [On] oznacza dwa elektrony 1s2 warstwy zamkniętej i teoretycznie nie uczestniczą w tworzeniu połączeń chemicznych.
Ponadto, ponieważ węgiel ma cztery elektrony walencyjne, „wygodnie” znajduje się w grupie 14 (VAT) stolika okresowego.
Elementy poniżej węgla (tak, ge, sn, pb i fl) mają wyższe liczby atomowe (i atomowe); Ale wszyscy mają wspólnego czterech elektronów Walencji. Jest to klucz do zrozumienia, dlaczego element należy do jednej grupy, a nie innej.
Elementy stolika okresowego
Bloki
Jak wyjaśniono, grupy 1 i 2 charakteryzują się posiadaniem jednego lub dwóch elektronów w orbitalach S. Te orbitale są geometrią sferyczną, a jak każda z tych grup jest zstąpiona, elementy nabywają warstwy, które zwiększają wielkość ich atomów.
W celu przedstawienia silnych trendów w swoich właściwościach chemicznych i sposobach reagowania, elementy te są zorganizowane jako blok s. Dlatego metale alkaliczne i metale alkaliniowe należą do tego bloku. Konfiguracja elektroniczna elementów tego bloku wynosi NS (1s, 2s itp.).
Chociaż element helu znajduje się na prawym górnym końcu tabeli, jego konfiguracja elektroniczna wynosi 1s2 I dlatego należy do tego bloku.
Blok p
W przeciwieństwie do bloków, elementy tego bloku mają całkowicie pełne orbitale, podczas gdy ich orbitale P nadal wypełniają się elektronami. Konfiguracje elektroniczne elementów należących do tego bloku są typu NS2NP1-6 (O orbitale mogą mieć jeden lub do sześciu elektronów do wypełnienia).
Więc w jakiej części okresowej tabeli jest ten blok? Po prawej: zielone, mieszkalne i niebieskie pudełka; To znaczy, elementy nie -metalowe i metale ciężkie, takie jak bizmut (BI) i ołów (PB).
Począwszy od boru, z konfiguracją elektroniczną NS2NP1, Węgiel po prawej dodaje kolejny elektron: 2s22 p2. Następnie konfiguracje elektroniczne innych elementów okresu 2 bloku p wynoszą: 2s22 p3 (azot), 2s22 p4 (tlen), 2s22 p5 (fluor) i 2s22 p6 (neon).
Jeśli niższe okresy zostaną obniżone, poziom energii 3: 323p1-6, I tak dalej do końca bloku p.
Należy zauważyć, że najważniejszą rzeczą w tym bloku jest to, że od okresu 4 jego elementy całkowicie wypełniły orbitale (niebieskie skrzynki do prawej). Podsumowując: blok S znajduje się po lewej stronie stolika okresowego i blok p, po prawej stronie.
Reprezentatywne elementy
Jakie są reprezentatywne elementy? Są to te, które z jednej strony łatwo traci elektrony lub z drugiej, wygrywają, aby ukończyć okT w Walencji. Innymi słowy: są elementami bloków S i P.
Może ci służyć: emulgator: proces emulsji, aspekty molekularne, zastosowaniaIch grupy odróżniały się od innych za pomocą litera A na końcu. Tak więc było osiem grup: od sztucznej inteligencji do VIIII. Ale obecnie system liczby stosowany w nowoczesnych tabelach okresowych jest arabski, od 1 do 18, w tym metale przejściowe.
Z tego powodu grupą Boro może być IIIA, lub 13 (3+10); grupa węglowa, VAT lub 14; i szlachetne gazów, ostatnie po prawej stronie stołu, viiia lub 18.
Metale przejściowe
Metale przejściowe to wszystkie elementy szarego pudełka. Przez całe okresy ich orbitale są wypełnione, które mają pięć i dlatego mogą mieć dziesięć elektronów. Ponieważ dziesięć elektronów powinno wypełnić orbitale, musi być dziesięć grup lub kolumn.
Każda z tych grup w starym systemie numerycznym została wyznaczona na liczbach rzymskich i literę B na końcu. Pierwszą grupą Scandio było IIIB (3), żelazo, kobalt i nikiel VIIIB dla bardzo podobnych reaktywności (8, 9 i 10) oraz w cynku IIB (12).
Jak widać, o wiele łatwiej jest rozpoznać grupy według liczb arabskich niż używanie liczb rzymskich.
Wewnętrzne metale przejściowe
Z okresu 6 stolika okresowego orbitale f zaczynają być dostępne energetycznie. Muszą one zostać wypełnione najpierw niż orbitale d; I dlatego jego elementy są zwykle rozkładane, aby nie przedłużyć zbyt wiele.
Ostatnie dwa okresy, pomarańczowy i szarawy. Istnieje siedem orbitali F, które potrzebują czternastu elektronów do wypełnienia, a zatem musi istnieć czternaście grup.
Jeśli grupy te zostaną dodane do tabeli okresowej, będzie w sumie 32 (18 + 14) i będzie miało wersję „wydłużoną”:
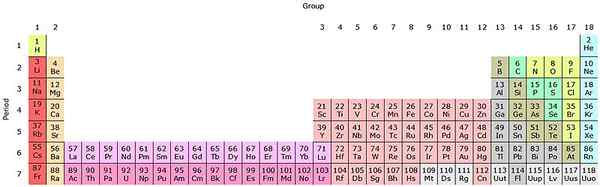 Źródło: przez Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons
Źródło: przez Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons Czysty różowy rząd odpowiada Lantanoides, podczas gdy ciemnogowy rząd aktynoidów. Lantano, z Z = 57, aktynio, AC z Z = 89, a cały blok F należy do tej samej grupy Scandio. Ponieważ? Ponieważ Scandio ma Orbital ND1, który jest obecny w pozostałej części Lantanoides i Actinoids.
I AC mają ustawienia 5D Valencia16s2 i 6d17s2. Gdy poruszasz się w samą porusza się na obu rzędach, orbitale 4F i 5F zaczynają się wypełniać. Po pełnym, docierasz do elementów Luthacio, Lu i Laurencio, LR.
Metale i nie -metalowe
Pozostawiając ciasto z okresowego stołu za sobą, wygodniej jest uciekać. W tej chwili zdecydowana większość wyżej wymienionych elementów to metale.
W temperaturze pokojowej wszystkie metale są substancjami stałymi (z wyjątkiem rtęci, które jest cieczy) srebrnego szarości (z wyjątkiem miedzi i złota). Są też zwykle twarde i genialne; Chociaż bloki S są miękkie i kruche. Elementy te charakteryzują się łatwością utraty elektronów i tworzenia kationów m+.
W przypadku lantanoidów trzy elektrony tracą 5D16s2 Stać się trójwartościowymi kationami m3+ (jak ona3+). Tymczasem wzgórze jest w stanie stracić cztery elektrony (CE4+).
Z drugiej strony elementy nie -metalowe stanowią najmniejszą część stolika okresowego. Są to gazy lub ciała stałe z kowalencyjnie połączonymi atomami (takimi jak siarka i fosfor). Wszystkie znajdują się w bloku P; Mówiąc dokładniej, w jej górnej części, ponieważ schodzenie do dolnych okresów zwiększa charakter metaliczny (BI, PB, PO).
Ponadto, nie -metal zamiast tracić elektrony, wygrywa. Tak więc tworzą aniony x- Z różnymi obciążeniami ujemnymi: -1 dla halogenów (grupa 17) i -2 dla calcogenów (grupa 16, tlen).
Może ci służyć: alkohol etylowy: struktura, właściwości, zastosowania, uzyskiwanieRodziny metalowe
W obrębie metali istnieje wewnętrzna klasyfikacja, aby je odróżnić od:
- Metale grupy 1 są alkaliczne.
- Grupa 2, metale alkaliczne (SR. Scholambara).
- Rodzina Scandio Group 3 (IIB). Ta rodzina składa się ze skandio, szefa grupy, ititrium i Lantano, Actinio i wszystkich Lantanoides i Actinoides.
- Grupa 4 (IVB), Titanium Family: TI, ZR (Circonium), HF (Hafnio) i RF (Rutherfordio). Ile ma elektronów Valencia? Odpowiedź jest w twojej grupie.
- Grupa 5 (VB), rodzina Vanadio. Grupa 6 (VIB), rodzina Chrome. I tak dalej do rodziny cynku, grupa 12 (IIB).
Metaloidy
Metaliczny znak wzrasta od prawej do lewej i od góry do dołu. Ale jaka jest granica między tymi dwoma rodzajami pierwiastków chemicznych? Ta granica składa się z elementów zwanych metaloidami, które mają charakterystykę zarówno metali, jak i nie -metalowych.
Metaloidy można zobaczyć w stole okresowym w „schodach”, które zaczynają się od boru, a kończy w elemencie radioaktywnym Astato. Te elementy to:
- B: Boro.
- Silicon: Tak.
- GE: Germanio.
- Jako: arsen.
- SB: Antymon.
- TE: Telurio.
- AT: Astato.
Każdy z tych siedmiu elementów wykazuje właściwości pośrednie, które różnią się w zależności od środowiska chemicznego lub temperatury. Jedną z tych właściwości jest półprzedaż, to znaczy metaloidy są półprzewodnikami.
Gazy
W warunkach naziemnych pierwiastki gazowe to te metale nie światła, takie jak azot, tlen i fluor. Również gazy chloru, wodoru i szlachetnych wchodzą w tę klasyfikację. Spośród nich najbardziej symboliczne są szlachetne gazy, ponieważ ich niska tendencja do reagowania i zachowania się jak wolne atomy.
Ten ostatni znajduje się w grupie 18 stolika okresowego i to:
- Helio, on.
- Neon, NE.
- Argon, AR.
- Kripton, Kr.
- Xenón, Xe.
- Radón, rn.
- I najnowszy ze wszystkich, szlachetny syntetyczny oglanowy gaz, OG.
Wszystkie gazy szlachetne mają wspólną konfigurację Valencia NS2NP6; Oznacza to, że ukończyli okT Walencji.
Państwa agregacji do innych temperatur
Elementy są w stanie stałych, ciekłym lub gazowym w zależności od temperatury i wytrzymałości ich interakcji. Jeśli temperatura Ziemi chłodzi, aż dookoła bezwzględna zero (0k), wszystkie elementy zamarzną; Z wyjątkiem helu, który by się skondensował.
W tej ekstremalnej temperaturze reszta gazów byłaby w postaci lodu.
Z drugiej strony, gdyby temperatura wynosiła około 6000 000, „wszystkie” elementy byłyby w stanie gazowym. W tych warunkach chmury złota, srebra, ołowiu i innych metali mogły dosłownie zaobserwować.
Znaczenie stolika okresowego
Obecnie tabela okresowa jest najważniejszym instrumentem organizacyjnym chemii ze względu na szczegółowe relacje jej pierwiastków. Jego zastosowanie jest niezbędne zarówno dla uczniów, jak i nauczycieli oraz dla naukowców i wielu specjalistów poświęconych oddziałowi chemii i inżynierii.
Po spojrzeniu na okres okresowy, ogromna ilość i informacje są uzyskiwane szybko i skutecznie, na przykład:
- Lit (li), beryl (be) i bor (b) prowadzić energię elektryczną.
- Lit to metal alkaliczny, beryl jest alkalicznym metalem, a bor nie ma metalu.
- Lit jest najlepszym motorem trzech wymienionych, a następnie berylum i, wreszcie bor (półprzewodnik).
Zatem poprzez zlokalizowanie tych elementów w tabeli okresowej, jego tendencję do przewodnictwa elektrycznego można natychmiast zakończyć.