Tabela kwantowa
- 3246
- 407
- Prokul Woliński
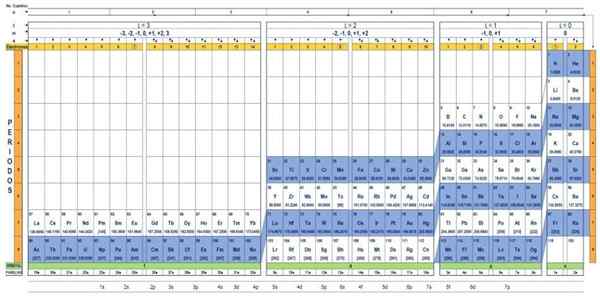
 Tabela kwantowa elementów. Źródło: Unam.
Tabela kwantowa elementów. Źródło: Unam. Jaki jest tabela kwantowa?
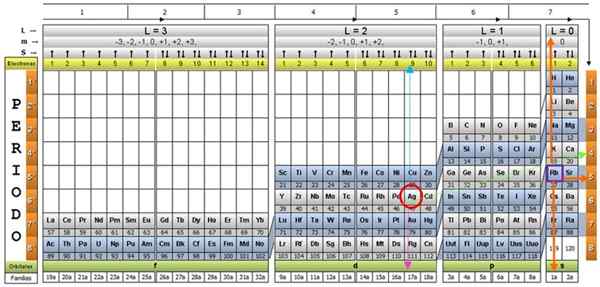
Tabela kwantowa Jest to sposób na zorganizowanie elementów chemicznych, zaprojektowanych w celu łatwego określenia zestawu liczb kwantowych, które charakteryzują każdą z nich.
Naukowcy odkryli, że w naturze wszystkich elementów istnieją pewne wzorce. Wśród tych wzorców są liczby kwantowe, cztery proste liczby opisujące konfigurację elektroniczną każdego elementu.
Liczby kwantowe powstają naturalnie z mechanicznego modelu atomu i są oznaczone literami: n, ℓ, mℓ i s. Opisują status energii elektronów w atomie każdego elementu chemicznego.
Za pomocą tradycyjnej stolika okresowego i niektórych dodatkowych narzędzi możliwe jest posiadanie elektronicznej konfiguracji atomu dowolnego elementu. Zaletą tabeli kwantowej jest to, że elementy są zorganizowane w taki sposób, że ich liczby kwantowe są natychmiast widoczne, bez konieczności dokonywania licznych obliczeń osobno.
Charakterystyka tabeli kwantowej
Istnieje kilka projektów tabel kwantowych. Model pokazany na powyższym rysunku zawiera:
- Nagłówek z czterema wierszami, z wartościami czterech liczb kwantowych, n, ℓ, i s, a także piąty rzędu w kolorze żółtym, co odpowiada liczbie elektronów na najbardziej zewnętrznej orbicie.
- Ciało tabeli, która składa się z siatki, która zawiera symbol elementu chemicznego, zaczynając od wodoru, w przedostatnim kolumnie prawej, a następnie hel i tak dalej. Poniższa liczba reprezentuje ilość elektronów atomowych w stanie podstawowym.
- Na dole, w zielonym rzędzie znajdują się cztery klasy do zorganizowania elementów: orbitale S, P, D i F (od lewej do prawej).
- Wreszcie, pod rządami orbitalnymi jest rodzina. Każda kolumna to rodzina, ponumerowana od 1 do 32. Na przykład pierwsze i 2. rodziny należą do klasy S, rodziny od 3 do 8A, należą do klasy P i tak dalej.
Jaka jest tabela kwantowa?
Tabela kwantowa służy do znalezienia zestawu liczb kwantowych, który charakteryzuje elektron z atomu. Zwykle elektrony te będą elektromagonem warstwy zewnętrznej, ponieważ są one określające zachowanie chemiczne pierwiastka.
Jak wygląda tabela kwantowa?
Tabela kwantowa pozwala łatwo znaleźć liczby kwantowe elektronów w najbardziej zewnętrznej warstwie atomu.
Przykład 1
Aby zilustrować tę procedurę, element aluminiowy jest traktowany jako przykład, którego symbol jest do. Pierwszym krokiem jest zlokalizowanie go w tabeli kwantowej, oznaczając go za pomocą czerwone koło:
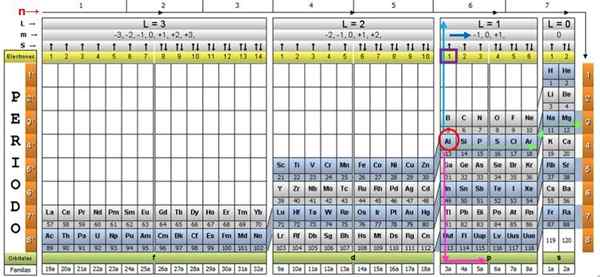
Krok 1: Znajdź n
Po zlokalizowaniu elementu w tabeli musisz przejść przez ten sam rząd i kolor, w prawo, aż dotrzesz do pomarańczowej kolumny, podążając drogą zielonej strzałki pokazanej na obrazie.
Strzałka wskazuje na oznaczone pudełko z numerem 3, które jest główną liczbą kwantową N:
n = 3
Krok 2: Znajdź ℓ
Aby określić wtórną liczbę kwantową, przestrzegana jest niebieska strzałka pionowa, co wskazuje:
ℓ = 1.
Krok 3: Znajdź M
Zewnętrzny aluminiowy elektron znajduje się w rodzinie publling p, jak można odczytać w zielonym rzędzie, do którego wskazuje różowa strzałka.
Ponadto ilość elektronów w ostatniej warstwie jest odczytywana w żółtym rzędzie nagłówka. W przypadku aluminium jest 1 elektron (podświetlony na Purple Plac), co jest odniesieniem. Łącząc powyższe wyniki, konfiguracja ostatniej warstwy to:
Może ci służyć: komórka galwaniczna: części, jak działa, aplikacje, przykłady3p1
Wiadomo, że warstwa P obsługuje maksymalnie 6 elektronów. A liczba M przyjmuje niektóre z całej wartości - ℓ, ( - ℓ+1),… 0,… (+ℓ −1),+ℓ.
Jak w tym przypadku ℓ = 1, wówczas m może wynosić −1, 0, 1.
Liczby te pojawiają się w rzędzie nagłówka odpowiadające M (patrz na obrazie Pozioma strzałka niebieski). Poniższa tabela służy jako przewodnik, aby wiedzieć, jaka jest wartość wyboru, w zależności od przypadku:
Ponieważ ostatnia warstwa aluminiowa ma 1 elektron, magnetyczna liczba kwantowa odpowiada
M = 1.
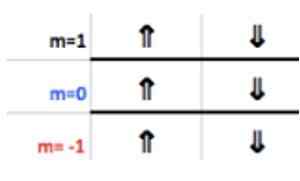
Krok 4: Znajdź S
Liczba spinów ma tylko dwie wartości: +½ lub - ½. W górnym polu, jeśli strzałka wskazuje, jest wybierana s = +½, a jeśli wskazuje, to s = - ½. W przypadku aluminium elektron 1 punkty w górę, zatem:
S = + ½.
Krótko mówiąc, liczba kwantowa elektronu zewnętrznej warstwy aluminium do dźwięku:
n = 3; ℓ = 1; M = 1, S = +½
Przykład 2 (wyjątkowe przypadki)
Silver AG i około dwudziestu kolejnych elementów to wyjątkowe przypadki, więc należy zachować ostrożność, gdy używa się z nimi tabeli kwantowej.
Jeśli poprzednia procedura zostanie powtórzona, Ag zostałby uzyskany jako ostatni poziom na 4D9.
Wynika to z faktu, że przewidywana konfiguracja La Plata według zasady Madelunga jest:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9
Jednak w praktyce AG nie podąża dokładnie za tą konfiguracją, ani żadne inne elementy, których ostatnia przewidywana warstwa to 4D9, takie jak miedź i złoto, między innymi (skonsultuj się z Internetem, aby uzyskać pełną listę elementów, które nie przestrzegają zasady Madelunga).
Może ci służyć: MolealistyPrawdziwa konfiguracja AG to:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
W którym elektron warstwy 5S2 skoczył do warstwy 4D9 Aby to ukończyć. W ten sposób stabilność atomu wzrasta. Dlatego ostatnim poziomem jest naprawdę:
5s1
A jego liczbami kwantowymi byłyby te odpowiadające elementowi RB, pokazane w fioletowym polu, z pomarańczowymi strzałkami wskazującymi na pozostałe liczby:
n = 5; ℓ = 0; M = 0; S = +½
 Przeglądając okresową tabelę, w efekcie widać, że AG jest w okresie 5, charakterystyka określona przez główną liczbę kwantową n.
Przeglądając okresową tabelę, w efekcie widać, że AG jest w okresie 5, charakterystyka określona przez główną liczbę kwantową n.
Różnice z okresem
Obie tabele są dwoma sposobami uporządkowania pierwiastków chemicznych zgodnie z cechami ich atomów:
-W tabeli okresowej elementy znajdujące się w tej samej kolumnie mają podobne właściwości chemiczne. Na przykład zaczyna się od kolumny metali alkalicznych po lewej i końce gazów szlachetnych po prawej stronie. Podczas gdy w szeregach są elementy o tym samym wyższym poziomie energii.
-Tabela kwantowa ma stopniowe usposobienie, zaprojektowane zgodnie z zasadami wypełniania. Dlatego musisz wykonać kroki, aby uzyskać główną liczbę kwantową, z wyjątkiem wyjątków, takich jak srebro, w przykładzie poprzedniej sekcji. Rodziny pierwiastków w tej tabeli są powiązane przez górną orbital, w S, P, D lub F.
Bibliografia
- Chang, R. 2013. Chemia. 11va. Wydanie. McGraw Hill Education.
- Elektroniczna Konfiguracja. Konfiguracja elektroniczna i liczby kwantowe. Pobrano z: ConfigUiionectronica.com.
- Podręcznik chemii. Źródło: DCB.Inżynieria.Unam.MX.
- Oficjalna chemia. Jak łatwe liczby kwantowe. Źródło: urzędnik chemii.com
- Triplenlace. Wyjątki od reguły Madelunga w elektronicznej konfiguracji pierwiastków chemicznych. Źródło: Triplenlace.com.

