Dostarczaj różnorodne cechy, struktura, funkcje
- 3647
- 448
- Estera Wojtkowiak
Dysmutas nadtlenek (Darń) albo utleniony nadtlenek, Stanowią rodzinę wszechobecnych enzymów w naturze, których główna funkcja polega na obronie organizmów aerobowych przed rodnikami pozbawionymi tlenu, zwłaszcza rodników anionowych nadtlenkowych.
Reakcja, którą katalizują te enzymy, występuje praktycznie we wszystkich komórkach, które są zdolne do oddychania (aerobik) i jest niezbędna do ich przeżycia, ponieważ eliminuje radykalne toksyczne toksyczne wolne od tlenu, zarówno w eukariotach, jak i prokariotach.
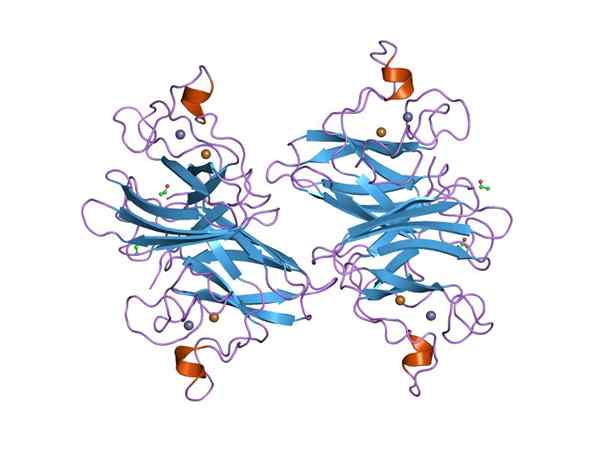
 Graficzna reprezentacja Dymputase Supertleside (SOD) Cu-Zn (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons)
Graficzna reprezentacja Dymputase Supertleside (SOD) Cu-Zn (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons) Wiele chorób u zwierząt jest związanych z gromadzeniem się różnych reaktywnych form tlenu, a to samo dotyczy roślin, biorąc pod uwagę, że środowisko nakłada liczne i stałe rodzaje stresu oksydacyjnego, które są przezwyciężone dzięki aktywności poniesiania nadtlenku.
Ta grupa enzymów została odkryta w 1969 roku przez McCorda i Fridovicha i od tego czasu dokonano znacznych postępów w zakresie tych enzymów i reakcji, które katalizują w żywych istotach.
[TOC]
Charakterystyka
Dysmutas nadtlenek reaguje z rodnikami nadksiężycowymi na naprawdę wysokie wskaźniki, co przekłada się na bardzo skuteczną linię obrony w celu usunięcia tych cząsteczek.
U ssaków opisano co najmniej trzy izoformy dla dysmutazy naprzód znanej odpowiednio jako SOD1, SOD2 i SOD3.
Dwie z tych izoform mają atomy miedzi i cynku w swoich centrach katalitycznych i różnią się od siebie pod względem ich lokalizacji: wewnątrzkomórkowe (cytozolowe, sod1 lub Cu/Zn) lub z elementami pozakomórkowymi (EC-SOD lub SOD3).
Izoforia SOD2 lub Mn-SOD, w przeciwieństwie do poprzednich dwóch, ma atom manganu jako kofaktor, a jego lokalizacja wydaje się ograniczona do mitochondriów komórek tlenowych.
Izoenzymy SOD1 są głównie w cytosolu, chociaż zostały również wykryte w przedziale jądrowym i lizosomom. Przeciwnie, izoenzymy SOD 3 zostały opisane w osoczu krwi ludzi, w płynach limfatycznych i mózgu.
Może ci służyć: w jaki sposób żywe istoty zmieniają się w czasie?Każda z tych izoform jest kodowana przez różne geny, ale należący do tej samej rodziny i jej regulacja transkrypcyjna jest zasadniczo kontrolowana przez warunki dodatkowe, które wyzwalają różne wewnętrzne wodospady sygnalizacyjne.
Inne zdezorienne nadtlenek
Dysmoniczny nadtlenek z miejscami katalitycznymi, które mają jony miedzi i cynku lub manganu, nie są unikalne dla ssaków, są one również obecne w innych organizmach, które obejmują rośliny i bakterie różnych klas.
Istnieje dodatkowa grupa nadtlenku dysmutów, które nie występują u ssaków, i które są łatwo rozpoznawalne, ponieważ w ich aktywnym miejscu mają żelazo zamiast któregokolwiek z trzech jonów opisanych dla innych klas dysmatycznego nadtlenku.
W I. coli, Otwardzinowy dysmi, które zawiera żelazo, jest enzymem perplastycznym również odpowiedzialnym za wykrywanie i eliminację rodników pozbawionych tlenu wytwarzanych podczas oddychania. Ten enzym jest podobny do tego znalezionego w mitochondriach wielu eukariotów.
Rośliny mają trzy typy enzymów: te, które zawierają miedź i cynk (Cu/Zn-Sod), które zawierają mangan (Mn-SOD) i te zawierające żelazo (Fe-SOD) w ich aktywnym centrum i w tych organizmach ćwiczą Analogiczne funkcje do funkcji enzymów niewitwowych.
Reakcja
Substraty enzymu dysmii-supertlenku są anionami nadtlenkowymi, które są reprezentowane jako O2- i które są związkami pośrednikami w procesie redukcji tlenu.
Reakcję, którą katalizują, można rozważać w ogólnych liniach, takich jak transformacja (spór) wolnych rodników do tworzenia molekularnego tlenu i nadtlenku wodoru, które są uwalniane odpowiednio do środowiska lub pracowników jako substratu z innych enzymów.
Może ci służyć: glukany: struktura, cechy i funkcjeNadtlenek wodoru można następnie wyeliminować z komórek dzięki działaniu dowolnej z enzymów glutationowych, ale peroksydazy, ale także ważnych funkcji w ochronie komórek.
Struktura
Dysmutas Izoenzymy nadtlenkowe u ludzi mogą różnić się od siebie pod względem niektórych aspektów strukturalnych. Na przykład izoenzym SOD1 ma masę cząsteczkową 32 kDa, podczas gdy SOD2 i SOD3 mają odpowiednio homotetryczne o masie cząsteczkowej 95 i 135 kDa.
Drugą grupą dysmatycznego ponadtlenku, Fe-Sod obecnego w roślinach i innych organizmach innych niż ssaki, są enzymy Dimérrica o identycznych podjednostkach, to znaczy są homodimerami.
W niektórych roślinach te fe-sod zawierają domniemaną N-końcową sekwencję sygnału do transportu we wnętrzu chloroplastów i innych zawierają trikierską sekwencję C-końcową C-końcową do peroksysomów, więc zakłada się, że jego rozkład podkomórkowy jest ograniczający oba przedziały.
Według alfa śmigieł alfa i arkuszy bolonych B Struktura trzech rodzajów enzymów nadmiernych.
Funkcje
Dysmoniczny nadtlenek broni komórek, narządów i tkanek ciała uszkodzeń, że rodniki pozbawione tlenu mogą powodować sposób peroksydacji lipidów, denaturacji białka i mutagenezy DNA.
U zwierząt te reaktywne gatunki mogą również powodować zmiany serca, przyspieszyć starzenie się i uczestniczyć w rozwoju chorób zapalnych.
Rośliny wymagają również niezbędnej aktywności enzymatycznej nadmiernej tlenku dysmutazy, ponieważ wiele stresujących warunków środowiska zwiększa stres oksydacyjny, to znaczy stężenie szkodliwych gatunków reaktywnych.
U ludzi i innych ssaków trzy izoformy opisane dla dysmutazy nadtlenku mają różne funkcje. Na przykład izoenzym SOD2 uczestniczy w różnicowaniu komórek i nowotworach, a także w ochronie toksyczności płuc indukowanej hiperoksją (wysokie stężenie tlenu).
Może ci służyć: inulina: struktura, właściwości, żywność, przeciwwskazaniaW przypadku niektórych gatunków bakterii patogennych enzymy SOD działają jako „czynniki wirulencji”, które pozwalają im pokonać wiele barier stresowych oksydacyjnych, z którymi mogą się spotkać podczas procesu inwazji.
Powiązane choroby
Zmniejszenie aktywności dysmutazy nadtlenkowej można podać kilka czynników, zarówno wewnętrznych, jak i zewnętrznych. Niektóre są związane z bezpośrednimi defektami genetycznymi w kodowaniu genów enzymów SOD, podczas gdy inne mogą być pośrednio, związane z ekspresją cząsteczek regulacyjnych.
Duża liczba patologicznych stanów ludzi jest związana z enzymami SOD, w tym otyłością, cukrzycą, rakiem i innymi.
W odniesieniu do raka ustalono, że istnieje duża liczba rodzajów guzów raka, które mają niski poziom jednego z trzech ssaków ssaków (SOD1, SOD2 i SOD3).
Stres oksydacyjny, że aktywność dysmutazy ponadtlenkowej zapobiega również z innymi patologiami stawów, takimi jak choroba zwyrodnieniowa stawów, reumatoidalne zapalenie stawów. Wiele z tych chorób ma związek z ekspresją czynników hamujących aktywność SOD, takich jak czynnik TNF-α.
Bibliografia
- Fridovich, ja. (1973). Swiden Dysmuta. Annu. Obrót silnika. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Dysmuty nadtlenkowe i wpływ IM na zdrowie ludzkie. Aspekty medycyny molekularnej, 26, 340-352.
- Oberley, l. W., & Bueftner, G. R. (1979). Rola nadtlenku wyróżnia się w raku: przegląd. Badania nad rakiem, 39, 1141-1149.
- Taylor, s. 1., Bowler, c., Camp, w. Van, Montagu, m. Van, Inzé, D., I pieczony, k. (2012). Nadtlenek rozzbrojeni w roślinach. Krytyczne recenzje w naukach roślinnych, 13(3), 37-41.
- Zelko, ja., Mariani, t., & Folz, r. (2002). Supertleside Distam Multigen Family: W porównaniu struktur genów CUZN-SOD (SOD1), Mn-SOD (SOD2) i EC-SOD (SOD3), ewolucja i ekspresja. Biologia wolna radykalna i medycyna, 33(3), 337-349.

