Struktura siarczanu sodu (Na2SO4), właściwości, stosowanie, uzyskiwanie

- 4455
- 823
- Pani Gilbert Stolarczyk
On siarczan sodu Jest to sól nieorganiczna, której wzorem chemicznym jest na2południowy zachód4. Składa się z białej substancji stałej, obecnej w trzech postaciach: bezwodnego, heptohydratu (niewielkiego egzystencji) i rozkładu (znanego jako sól Glabert); Ta ostatnia jest najliczniejszą postacią siarczanu sodu.
Rozkład siarczanu sodu, na2południowy zachód4· 10H2Lub został odkryty w 1625 r. Przez Glauberta w wodzie wiosny, który wyznaczył go Saltabilis (cudowną sól) ze względu na jego właściwości lecznicze.
 Szkło zegarowe z próbką siarczanu sodu. Źródło: Walkerma przez Wikipedia.
Szkło zegarowe z próbką siarczanu sodu. Źródło: Walkerma przez Wikipedia. Siarczan sodu ma wiele zastosowań w branży tekstylnej i papierowej, a także w produkcji szklanych. Jego zastosowania są rozszerzone o zastosowania termiczne, które obejmują środowiskowe zasilanie ciepła i chłodzenie laptopów.
Siarczan sodu jest związkiem o niskiej toksyczności i jego szkodliwych działaniach, są one zasadniczo mechaniczne i niechemiczne. Z przyczyn krystalograficznych ta sól, podobnie jak jej odpowiednik poetesasu, k2południowy zachód4, przedstawia ramy i struktury polimorficzne.
[TOC]
Struktura
Bezwodna sól
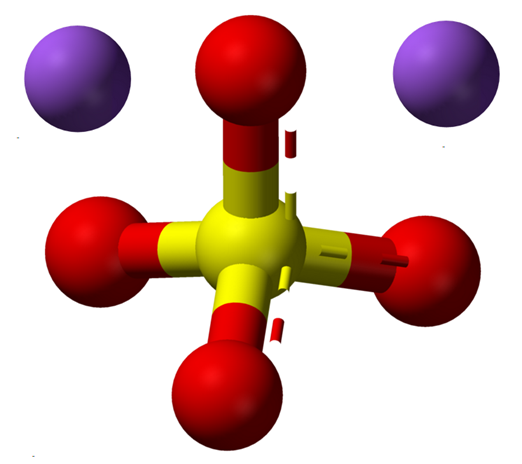 Bezwodne jony siarczanu sodu. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Bezwodne jony siarczanu sodu. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Formuła Na2południowy zachód4 Wskazuje, że jony Na w kryształach soli+ A więc42- Są w związku 1: 2; to znaczy na każde dwa katacje na+ Jest anion42- interakcja z nimi za pomocą przyciągania elektrostatycznego (obraz doskonały).
Oczywiście dotyczy to NA2południowy zachód4 bezwodne, bez cząsteczek wody skoordynowanych z sodem wewnątrz kryształów.
 Siarczan sodu
Siarczan sodu Pomimo prostego wyglądu, jego opis strukturalnie jest złożony. Następnie2południowy zachód4 Przedstawia polimorfizm, mając do pięciu faz krystalicznych: I, II, III, IV i V, których temperatury przejściowe wynoszą odpowiednio 180, 200, 228, 235 i 883 ºC,.
Chociaż nie ma odniesień, które to poświadczają, Na2południowy zachód4I to musi być ten, który ma sześciokątną strukturę krystaliczną, bardziej gęste w porównaniu z na ortorombowym2południowy zachód4Iii, w których kryształach na+ Forma tetrahedra (nao4) i oktahedros (nao6) koordynacja; Oznacza to, że może być otoczony czterema lub sześcioma anionami42-.
Sól tupnedratada
Tymczasem monokliniczna krystaliczna struktura jego najważniejszego hydratu, na2południowy zachód4· 10H2Lub to prostsze. W nim praktycznie cząsteczki wody, które oddziałują lub koordynują z Na+ W Octahedrze na (h2ALBO)6+, Z SO42- ledwo przyczyniając się do wystarczającej stabilności do szkła, aby istnieć w fazie stałej.
Może ci służyć: pierwsza rewolucja chemiiJednak jego temperatura topnienia (32,38 ° C) znacznie niższa niż w przypadku bezwodnej soli (884 °2południowy zachód4.
Nieruchomości
Nazwy
-Siarczan sodu (IUPAC)
-Sól goberu (odwodnienie)
-Sala cuda (rozkładacz)
-Siarczan disodum.
Masa cząsteczkowa
142,04 g/mol (anh¡dro)
322,20 g/mol (dekodat)
Wygląd fizyczny
Białe higroskopowe krystaliczne ciało stałe
Zapach
Toaleta
Smak
Gorzki i soli fizjologicznej
Gęstość
2664 g/cm3 (bezwodny)
1464 g/cm3 (Dahydrate)
Zwróć uwagę, w jaki sposób cząsteczki wody wewnątrz kryształów powodują ich rozszerzenie, a zatem zmniejszają ich gęstość.
Temperatura topnienia
884 ° C (bezwodny)
32,38 ° C (dekodat)
Punkt wrzenia
1.429 ° C (bezwodny)
Rozpuszczalność wody
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ° C)
42,7 g/100 ml (100 ºC)
Wszystkie wartości rozpuszczalności odpowiadają bezwodnej soli, która jest dość rozpuszczalna w wodzie we wszystkich temperaturach.
Rozpuszczalność gwałtownie wzrasta między 0 ºC a 38,34 °. Jednak z 32,38 ° C rozpuszczalność jest niezależna od temperatury.
Zdarza się, że w temperaturze 32,8 ºC rozkładane siarczan sodu rozpuszcza się we własnej krystalicznej wodzie. Dlatego równowaga między solą rozkładającą, sól anhydry i nasyconym roztworem siarczanu sodu.
Tak długo, jak utrzymuje się warunek trójfazowy, temperatura pozostanie stała, co pozwala na kalibrację temperatury termometrów.
Z drugiej strony rozpuszczalność soli heptahydratu to:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ° C)
Zauważ, że w 20 ° C sól heptahydratu jest trzy razy bardziej rozpuszczalna niż bezwodna.
Współczynnik załamania światła
1468 (bezwodny)
1 394 (dekodrat)
Stabilność
Stabilne w zalecanych warunkach przechowywania. Niezgodne z silnymi kwasami i zasadami, aluminium i magnezem.
Rozkład
Kiedy jest ogrzewany do rozkładu, emituje toksyczny dym tlenku siarki i tlenku sodu.
Ph
5 % roztwór wodny ma pH 7.
Reaktywność
Siarczan sodu dysocjuje w roztworze wodnym w 2 na+ A więc42-, co umożliwia połączenie jonu siarczanu z BA2+ W celu wytrącania siarczanu baru. Praktycznie pomaga poruszać jony baru próbek wody.
Może ci służyć: transaminacjaSiarczan sodu staje się siarczkiem sodu przez reakcję w wysokich temperaturach z węglem:
Na2południowy zachód4 + 2 c => na2S +2 co2
Sól Glauberta, Naso4.10h2O Reaguje z węglanem potasu w celu wytwarzania węglanu sodu.
Aplikacje
Przemysł papierowy
Siarczan sodu jest stosowany w produkcji pulpy papierowej. Jest używany w opracowaniu papieru Kraft, który nie zawiera ligniny ani nie poddaje się procesie bielenia, powód, który daje mu wielki opór. Ponadto jest używany w produkcji kartonowej.
Detergenty
Jest stosowany jako syntetyczny materiał napełniający detergent do użytku w domu, dodając do detergentu w celu zmniejszenia napięcia powierzchniowego.
Szkło
Jest stosowany w produkcji szkła w celu zmniejszenia lub wyeliminowania obecności małych pęcherzyków powietrza w stopionym szkle. Dodatkowo eliminuje tworzenie żużla podczas stopionego procesu rafinacji szkła.
Przemysł włókienniczy
Siarczan sodu jest stosowany jako mordant, ponieważ ułatwia interakcję barwników z włóknami tkaninowymi. W teście barwnika stosuje się detahydowany siarczan sodu.
Ponadto siarczan sodu jest stosowany jako rozcieńczony barwnik i pomocniczy środek drukowania barwnika; takie jak barwniki bezpośrednich, barwniki siarki i inne środki, które sprzyjają barwieniu bawełnianym. Jest również używany jako agent, który opóźnia barwniki z jedwabiu.
Medycyna
Dekhrid siarczan sodu jest stosowany jako środek przeczyszczający, ponieważ jest mało wchłaniany w jelicie, a zatem pozostaje w świetle tego, powodując wzrost objętości. Stymuluje to wzrost skurczów perystaltycznych, które indukują wydalenie zawartości jelit.
Siarczan sodu jest antidotum do kontrolowania zatrucia barem i sole ołowiu. Sól Glauberta jest skuteczna w eliminacji niektórych leków nadmiernie połkniętej; Na przykład paracetamol (acetoaminofen).
Ponadto służy do dostarczania słabych elektrolitów z obecnością w roztworach izoosmotycznych.
Środek suszący
Siarczan sodu, ponieważ jest odczynnikiem obojętnym, stosuje się do usuwania wody z roztworów złożonych organicznych.
Surowiec
Siarczan sodu jest stosowany jako surowiec do produkcji licznych substancji, w tym: siarczku sodu, węglanu sodu i siarczanu amonu.
Może ci służyć: chromatografia gazowaUzyskanie
Siarczan sodu uzyskuje się przez wydobycie ekstrakcji i reakcje chemiczne.
Ekstrakcja wydobycia
Istnieją trzy rudy lub minerały, które są wykorzystywane z wydajnością komercyjną: thenardita (na2południowy zachód4), Mirabilita (na2południowy zachód4· 10H2O) i glaubarita (na2południowy zachód4·Sprawa4).
W Hiszpanii depozyty Thenardita i Mirabilita są wykorzystywane przez podziemne wydobycie galerii i filarów. Tymczasem Glauberita jest uzyskiwana na otwartej części, przez duże tratwy, które są umieszczane na zbiorniku mineralnym.
Teren jest przygotowywany z niską intensywnością, aby uzyskać porowatość, która umożliwia wymywanie siarczanu sodu. Faza produkcyjna występuje wraz z tryskarem nawadnianiem słodką wodą z Glauberita, której ługowanie propaguje się w malejący sposób.
Solanka siarczanu sodu jest zbierana, a pozostałość siarczanu wapnia jest wypełniona.
Produkcja chemiczna
Siarczan sodu uzyskuje się podczas produkcji kwasu solnego w dwóch procesach: proces Mannheim i proces Hardgrenave.
Proces Mannheim
Odbywa się to w dużych stalowych piecach i z 6 -m stalową platformą reakcyjną. Reakcja występuje między chlorkiem sodu a kwasem siarkowym:
2 NaCl +H2południowy zachód4 => 2 hcl +na2południowy zachód4
Proces hardreave
Obejmuje reakcję chlorku sodu, tlenku siarki, tlenu i wody:
4 NaCl + 2 SO2 + ALBO2 + 2 godz2O => 4 hcl +na2południowy zachód4
Inni
Siarczan sodu występuje w reakcji neutralizacji między wodorotlenkiem sodu a kwasem siarkowym:
2 naoh +h2południowy zachód4 => Na2południowy zachód4 + H2ALBO
Siarczan sodu jest produktem ubocznym produkcji licznych związków. Jest ekstrahowany z odpadów ciekłych zwolnionych podczas produkcji wiskozy i celofanu. Również w produkcji dichromianu sodu, fenoli, kwasu borowego i karbaminianu litu.
Ryzyko
Siarczan sodu jest uważany za związek o niskiej toksyczności. Może jednak spowodować pewne szkody osobie, która używa go nieodpowiednich.
Na przykład możesz spowodować podrażnienie oka, zaczerwienienie i ból. W skórze może powodować podrażnienie i alergię u niektórych osób. Jego spożycie może powodować podrażnienie przewodu pokarmowego z nudnościami, wymiotami i biegunką. I wreszcie, jego wdychanie powoduje podrażnienie w dróg oddechowych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Siarczan sodu. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Siarczan sodu. Baza danych Pubchem. CID = 24436. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- B. N. Mehrotra. (1978). Struktura krystaliczna Na2południowy zachód4Iii. Odzyskane z: rruff-2.Geo.Arizona.Edu
- Glauberita-Thenardita (siarczan sodu). [PDF]. Odzyskane z: igme.Jest
- « Struktura tlenku cynku (ZnO), właściwości, zastosowania, ryzyko
- Charakterystyka błękitu laktofenolu, skład, przygotowanie, zastosowania »

