Saletra amonowa
- 1635
- 51
- Prokul Woliński
Wyjaśniamy, co to jest siarczan amonu, jego struktura chemiczna, właściwości fizyczne i chemiczne oraz zastosowania
Co to jest siarczan amonu?
On saletra amonowa Jest to trójskładnikowa i amoniak nieorganiczna sól kwasu siarkowego. Jego wzór chemiczny jest (NH4)2południowy zachód4. Dlatego proporcje stechiometryczne mówią, że dla każdego anionu siarczanowego oddziałują z nim dwa kationy amonowe. Umożliwia to neutralność soli ((+1) ∙ 2 + (-2)).
Jego nomenklatura wynika z faktu, że jest solą pochodzącą z H2południowy zachód4, Zmiana sufiks „URIC” dla „ATO”. Zatem dwa początkowe protony są zastępowane przez NH4+, produkt reakcji z amoniakiem (NH3). Tak więc równanie chemiczne dla jego syntezy to: 2 NH3 + H2południowy zachód4 => (NH4)2południowy zachód4
Siarczan amonu jest również wytwarzany przez reakcję węglanu amonu z siarczanem wapnia: (NH4)2WSPÓŁ3 + Sprawa4 => (NH4)2południowy zachód4 + Złodziej3, wytrącanie węglanu Calico, który jest oddzielony od pozostałej cieczy.
Siarczan amonu to magazyn azotu i siarki, zarówno niezbędny w chemii gleby, jak i nawozów.
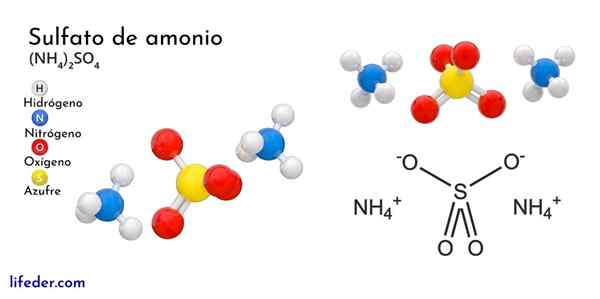
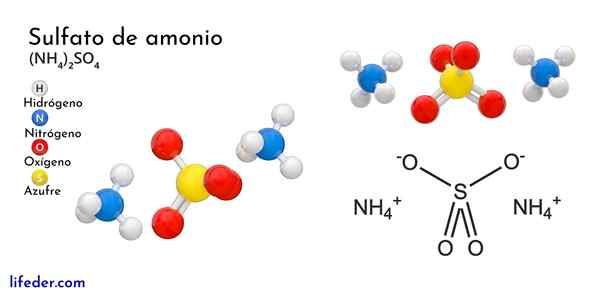
Struktura chemiczna siarczanu amonu

Najwyższy obraz ilustruje geometrię molekularną jonów NH4+ A więc42-. Czerwone kule odpowiadają atomom tlenu, atomom białym do wodoru, atomem niebieskiego do azotu i żółtych do atomu siarki.
Oba jony można uznać za dwa tetrahedry, a tym samym trzy jednostki, które oddziałują w celu utworzenia ortorombowego układu krystalicznego. Siarczany anion jest taki42- I jest w stanie przekazać lub zaakceptować cztery mosty wodorowe, a także kation NH4+.
Właściwości siarczanu amonu
Waga molekularna
132 134 g/mol.
Może ci służyć: związek chemii i technologii z istotami ludzkimi, zdrowiem i środowiskiemWygląd fizyczny
Biały stał. Białe lub brązowe kryształy ortorrbiewne, w zależności od poziomów zanieczyszczeń.
Zapach
Toaleta.
Temperatura topnienia
280 ° C. Ta temperatura topnienia, pod innymi związkami jonowymi, wynika z tego, że jest to sól z monowalentnymi kationami (+1) i z jonami ukrytymi w jego rozmiarach, powodując, że substancja substancji stała ma niską krystaliczną energię siatkową.
Rozpuszczalność
76,4 g/100 g wody w 25 ° C. To powinowactwo do wody wynika z wielkiej zdolności ich cząsteczek do rozwiązywania jonów amonowych. Z drugiej strony jest nierozpuszczalny w acetonie i alkoholu; to znaczy w mniej polarnych rozpuszczalnikach niż woda.
Gęstość
1,77 g/cm3 w 25 ° C.
Ciśnienie pary
1 871 kPa w 20 ° C.
Punkt flash
26 ° C.
Ph
5.0 - 6,0 (25 ° C. Rozwiązanie 1 m). Nieco kwaśne pH jest spowodowane hydrolizą NH4+ W wodzie, wytwarzając h3ALBO+ przy niskich stężeniach.
Stabilność
Stabilne w odpowiednich warunkach środowiskowych. W kontakcie z silnymi utleniaczami może podpalić.
Rozkład
Zaczyna rozkładać się w temperaturze 150 ° C, uwalniając toksyczne opary tlenku siarki, tlenek azotu i amon.
Korozja
Nie atakuje żelaza ani aluminium.
Zastosowania siarczanu amonu
W rolnictwie
- Siarczan amonu jest stosowany jako nawóz w glebach alkalicznych. Sól amonu ma 21 % azotu i 24 % siarki w swoim składzie. Istnieją jednak związki, które zapewniają ilość azotu większą niż siarczan amonu; Zaletą tego ostatniego jest wysokie stężenie siarki.
- Siarka jest niezbędna w syntezie białek, ponieważ kilka aminokwasów - takich jak cystyna, metionina i cysteina - ma siarkę. Z tych powodów siarczan amonu nadal jest jednym z najważniejszych nawozów.
- Jest stosowany w uprawach pszenicy, kukurydzy, ryżu, bawełny, ziemniaków, konopi i owoców.
- PH gleb alkalicznych spadły o ich wkład w proces nitryfikacji przeprowadzany przez drobnoustroje. Stosuje się amon (NH4+) w celu produkcji azotanu (nie3-) i uwolnij h+: 2nh4+ + 42 => 2no3- + 2h2O + 4H+. Wzrost stężenia wodoru zmniejsza pH gleb alkalicznych i pozwala na większe stosowanie.
- Oprócz jego zastosowania jako nawozu siarczan amonu działa jako adiuwant rozpuszczalnych środków owadobójczych, herbicydów i grzybobójczych, które są spryskiwane na uprawy.
- Siarczan jest zdolny do porwania jonów obecnych w wodzie gleby i nawadnianiu, które są niezbędne do życia niektórych patogenów. Wśród jonów, które wychwytuje siarczan amonu2+, Mg2+, wiara2+ i wiara3+. To działanie zwiększa drobnoustrojowy efekt wyżej wymienionych czynników.
Jako odczynnik analityczny
Siarczan amonu działa jako środek wytrącający się w analizie elektrochemicznej, pośród hodowli mikrobiologicznej i w przygotowaniu soli amonowych.
W wytrącaniu i izolacji białkowej
Siarczan amonu jest stosowany w izolacji i oczyszczaniu białka, zwłaszcza w osoczu. Do osocza dodaje się ilość siarczanu amonu, aby doprowadzić go do pewnego stężenia; Zatem spowodowane jest wytrącanie grupy białkowej.
Zebrano osad przez wirowanie, a supernatant dodaje dodatkową ilość siarczanu amonu i, do nowego stężenia, wytwarzane jest wytrącanie innej grupy białka.
Powtórzenie poprzedniego procesu sekwencyjnie pozwala na uzyskanie różnych frakcji białkowych w osoczu.
Przed pojawieniem się nowych technologii biologii molekularnej procedura ta pozwoliła na izolację białek osocza o ogromnym znaczeniu w medycynie, na przykład: immunoglobuliny, czynniki krzepnięcia itp.
W przemyśle
Siarczan amonu działa poprzez opóźnienie rozpoczęcia pożaru w przemyśle tekstylnym. Jest używany jako addytywny w branży elektroenchapado. Jest również stosowany w produkcji nadtlenku wodoru, chlorku amonu itp.
Inne zastosowania
- Siarczan amonu jest stosowany jako czynnik regulacyjny ciśnienia osmotycznego i jako środek wytrący sole.
- W postaci laulu siarczanu amonu zmniejsza napięcie powierzchniowe wody, umożliwiając w ten sposób rozdzielenie zanieczyszczeń przez wzrost twardości wody.
- Jest środkiem antykoorosiowym.
- Jest stosowany jako dodatek do żywności, który reguluje kwasowość w ciastu mąki i chlebie.
- « Koncepcja misji i osobistej wizji, jak to robić, przykłady
- Późniejsze sole, czym są nomenklatura, nieruchomości, przykłady »