Rozwiązania chemiczne
- 4477
- 308
- Maksymilian Kępa
Wyjaśniamy, jakie rozwiązania chemiczne, ich cechy, istnieją i podajemy kilka przykładów
 Chemikalia jest jednorodną mieszanką między dwiema substancjami
Chemikalia jest jednorodną mieszanką między dwiema substancjami Jakie są rozwiązania chemiczne?
Rozwiązania chemiczne Są to jednorodne mieszanki między rozpuszczalnikiem a jedną lub więcej substancji rozpuszczonych. Najprostsze rozwiązania są tworzone przez jedną substancję rozpuszczoną i rozpuszczalnik, na przykład gdy rozpuszczamy cukier w wodzie, ale istnieją roztwory, które mogą stać się bardzo złożone z setkami substancji rozpuszczonych.
Najczęstsze roztwory są w stanie płynnym, aw większości przypadków rozpuszczalnikiem jest woda. Z tego powodu woda jest zwykle nazywana „uniwersalnym rozpuszczalnikiem”. Ale roztwory nie ograniczają się do cieczy, ponieważ istnieją roztwory w stanie gazowym i stałym.
Substancję substancji rozpuszczonej można również znaleźć w różnych stanach. Na przykład ciekłe roztwory z stałymi substancjami substancji rozpuszczonych (takich jak sól), płynami (takimi jak alkohol) lub gazowy (taki jak gaz węglowy w napojach bezalkoholowych) mogą mieć roztwory stałe).
Jak rozpoznać substancję rozpuszczoną i rozpuszczalnikiem?
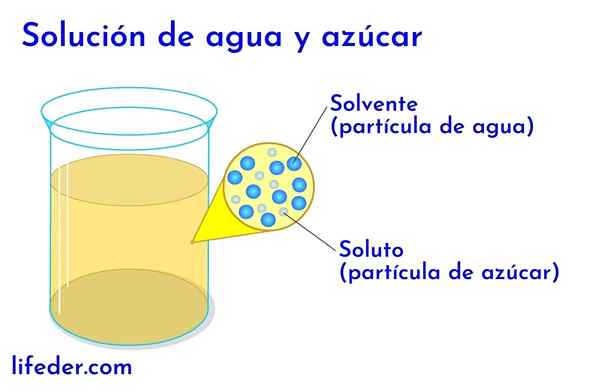
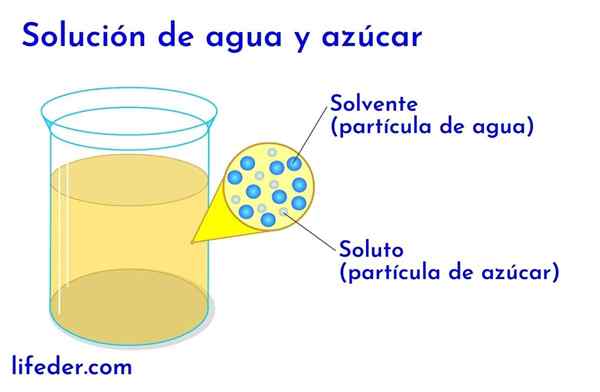 Substancja rozpuszczona i rozpuszczalnik w wodzie z cukrem
Substancja rozpuszczona i rozpuszczalnik w wodzie z cukrem W każdym rozwiązaniu, w którym jest woda, jest to uważane za rozpuszczalnik. We wszystkich innych przypadkach rozpuszczalnik odpowiada komponentowi, który jest w większej ilości lub w większej proporcji i prawie zawsze jest płynnym. Pozostałe elementy obecne w roztworze są uważane za substancje rozpuszczone.
Spójrzmy na dwa przykłady:
- W roztworze wody i cukru woda jest rozpuszczalnikiem i cukrem substancją substancji rozpuszczonej.
- Alkohol izopropylowy, który kupujemy w aptece, jest roztworem utworzonym przez wodę i alkohol. W tym roztworze rozpuszczalnikiem jest woda, mimo że jest w mniejszej proporcji niż alkohol.
Charakterystyka i właściwości roztworów chemicznych
Są to jednorodne mieszanki
Rozwiązania są mieszaninami, w których rozpuszczalnik nie można rozróżnić ani na gołym okiem, albo przy użyciu szkła powiększające.
Mają jednolity skład
Oznacza to, że każda część roztworu zawsze będzie miała te same elementy (substancja rozpuszczona i rozpuszczalnik) do tego samego stężenia.
Może ci służyć: kadm (CD): historia, właściwości, struktura, zastosowaniaCharakteryzują się ich koncentracją
Stężenie jest jedną z najważniejszych cech roztworu, ponieważ określa wiele jego właściwości.
Są półprzezroczyste (przezroczyste)
Płynne roztwory muszą być półprzezroczyste, to znaczy światło musi być w stanie je przekroczyć bez rozproszenia.
Są stabilne
Rozwiązanie, w którym substancja rozpuszczalna i rozpuszczalnik nie reagują na siebie, będzie stabilne w nieskończoność. Oznacza to, że z czasem nie ulegnie żadnej zmianie, o ile jego skład pozostanie stały (na przykład rozpuszczalnik nie odparowuje)).
Jego właściwości fizyczne i chemiczne różnią się od właściwości rozpuszczalnika
Właściwości fizyczne i chemiczne zmiany rozpuszczalnika podczas mieszania z substancją rozpuszczoną. Na przykład roztwory mają większą temperaturę wrzenia, niższą temperaturę topnienia, a także wysokie ciśnienie osmotyczne w porównaniu z czystym rozpuszczalnikiem.
Można je oddzielić przez niektóre procesy fizyczne i chemiczne
Rozwiązania nie można oddzielić przez filtrację, wirowanie lub dekantacja. Można je oddzielić jedynie metodami fizycznymi lub chemicznymi, takimi jak krystalizacja, destylacja, parowanie, odwrócona osmoza i chromatografia,.
 Instrumenty destylacyjne
Instrumenty destylacyjne Rodzaje rozwiązań chemicznych
Roztwory chemiczne można klasyfikować zgodnie z ich stężeniem, zgodnie z ich stanem fizycznym i zgodnie z naturą rozpuszczalnika:
Według twojej koncentracji
- Nienaturowane rozwiązania: Są tymi, w których substancja rozpuszczona nie osiągnęła jeszcze maksymalnego stężenia w rozpuszczalniku. Z tego powodu więcej substancji rozpuszczonej można rozpuścić, aby przygotować bardziej skoncentrowany roztwór.
- Nasycone rozwiązania: Są rozwiązaniami, w których rozpuszczalnik nie może już rozpuścić więcej substancji rozpuszczonej. W takich przypadkach zawsze istnieje część substancji rozpuszczonej bez rozpuszczenia. Na przykład, jeśli dodamy dużo soli do szklanki z wodą, część tej soli nie rozpuści się i pozostanie na dnie szkła.
- Przesycone rozwiązania: Są to rozwiązania, w których jest więcej rozpuszczonej substancji rozpuszczonej niż rozpuszczalnik. Można to osiągnąć poprzez podgrzanie nasyconego roztworu w celu rozpuszczenia jeszcze większej substancji substancji rozpuszczonej, a następnie pozostawienie powoli chłodzących do początkowej temperatury. Rozwiązania te są niestabilne, ponieważ wszelkie zaburzenia, takie jak wibracje lub niewielka cząstka pyłu na powierzchni, mogą powodować oddzielenie nadmiaru substancji rozpuszczonej.
Według twojego stanu fizycznego
- Płynne roztwory: Są najczęstsze. W tego typu roztworach rozpuszczalnik jest płynem (taki jak woda, alkohol, olej itp.) Ale substancja substancji rozpuszczonej można znaleźć w dowolnym stanie (stałe, ciekłe lub gazowe). Niektóre przykłady płynnych roztworów to słona woda, wino i napoje bezalkoholowe.
- Solidne rozwiązania: W takich przypadkach zarówno rozpuszczalnik, jak i substancja rozpuszczona są w stanie stałym. Najczęstszymi przykładami tego rodzaju roztworów są stopy metali, takie jak brąz, stal i mosiądz, ale istnieją również inne przykłady, takie jak szkło.
- Rozwiązania gazowe: Jak sama nazwa wskazuje, są to jednorodne mieszanki, w których wszystkie elementy są w stanie gazowym.
Według rozpuszczalnika
- Wodne rozwiązania: Jeśli w roztworze rozpuszczalnikiem jest woda, mówi się, że jest to roztworze wodne. Są to najczęstsze rozwiązania, które można znaleźć w życiu codziennym.
- Rozwiązania alkoholowe: Najczęstszym rozpuszczalnikiem po wodzie jest alkohol. Wśród najczęstszych alkoholi są metanol, etanol i alkohol izopropylowy.
- Rozwiązania w innych rozpuszczalnikach organicznych: Istnieje wiele innych związków organicznych, które są stosowane jako rozpuszczalniki. Należą do nich niektóre alkany, większość eterów, płynnych ketonów i innych.
Przykłady rozwiązań chemicznych
Lemoniada
Jest to wodny roztwór utworzony przez wodę jako rozpuszczalnik i sok z cytryny oraz cukier jak substancje rozpuszczone.
Woda morska
Woda morska lub słona jest wodnym roztworem złożonym z wody i mieszanki soli. Wśród tych soli, najbardziej proporcjonalnym jest chlorek sodu (NaCl) znany jako wspólna sól stołowa.
Może ci służyć: tlenek rtęci (HG2O)Skoncentrowany syrop
Jest to roztwór wodny prawie nasycony wodą cukrową.
Woda gazowana
Woda gazowana, znana również jako soda, jest wodnym roztworem gazowego dwutlenku węgla (CO2) W wodzie.
Powietrze
Powietrze jest gazowym roztworem, w którym azot można uznać za rozpuszczalnik i tlen i inne gazy jako substancje rozpuszczone.
Klarowane masło
Stopiąc masło i usuwając całą pianę, uzyskuje się przezroczysty żółty roztwór zwany masłem klarowanym. Jest to rozwiązanie, w którym zarówno rozpuszczalnik, jak i substancje rozpuszczalne są tłuszczowe.
Kolorowe szkło
Kolorowe szkło są roztworami w stanie stałym, w których rozpuszczalnikiem jest stopiona krzemionka, a substancje rozpuszczalne to inne minerały, które zapewniają szkło charakterystyczny kolor.
Kawa
Jest to złożone wodne rozwiązanie, które zawiera wiele substancji rozpuszczonych (wśród nich kofeina), które nadają napojowi charakterystyczny aromat i smak.
Stal
Stal jest stopem lub stałym roztworem utworzonym przez metaliczne żelazo i węgiel grafitowy.
Osocze krwi
W osoczu krwi jest roztworem uzyskiwanym po odwirowaniu krwi w celu usunięcia wszystkich komórek i innych zawieszonych ciał stałych. Jest to dość skoncentrowane wodne roztwór, który zawiera setki substancji rozpuszczonych, w tym węglowodany, aminokwasy, białka rozpuszczalne i elektrolity,.
Bibliografia
- Chang, R. i Goldsby, K. (2014). Chemia. 11 wyd. Nowy Jork: McGraw-Hill Education.
- Rozwiązanie (25 stycznia 2021). W Wikipedii.org.
- Brown, t. L., Lemay, e. (2018). Chemia: Centralna nauka. 14. edycja. osoba.
- Krestonosich, s., i inni. (1992). Rozwiązania. Redakcja miró.
- Vidal, J. DO. (Redaktor) (1997). Interaktywny mentor - encyklopedia tematyczna studentów. Redakcja oceaniczna. Barcelona.

