Struktura krystalicznej ciał stałych, właściwości, typy, przykłady

- 4262
- 627
- Herbert Wróblewski
Krystalne stałe Są to te, których struktury mikroskopijne są uporządkowane i są posłuszne charakterystycznemu wzorowi dla pewnej sieci krystalicznej; Na przykład: sześcienne, sześciokątne, trójklinowe, Rhomboédrica,.
Mówi się, że te ciała stałe istnieją jako kryształy, które pokazują aspekty i geometryczne projekty odzwierciedlające to, jak uporządkowane są w środku. Inne przykłady krystalicznych stałych są diament, kwarc, antracen, suchy lód, chlorek potasu lub tlenek magnezu.
 Krystaliczny bar kryminalny. Źródło: Pixabay.
Krystaliczny bar kryminalny. Źródło: Pixabay. Para znanych krystalicznych ciał stałych to cukier i sól (NaCl). Na pierwszy rzut oka oba noszą białe kryształy; Ale jego właściwości różnią się znacznie. Cukier jest molekularną krystaliczną stałą, a sól jest jonowym krystalicznym stałym. Pierwszy składa się z cząsteczek sacharozy; A drugi z jonów Na+ i Cl-.
Górny obraz pozwala dostrzec, jak jasne mogą być kryształy cukru. Jednak kryształy soli nie są daleko w tyle. Chociaż cukier i sól wyglądają jak bracia, ich struktury są różne: cukier, który staje się sacharozą, ma strukturę monokliniczną; Podczas soli, struktura sześcienna.
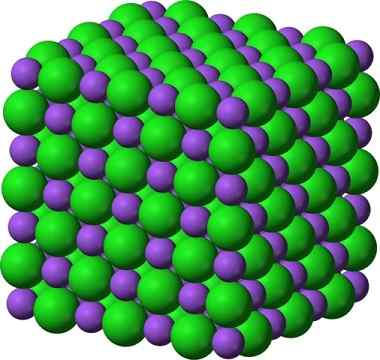 Krystaliczna struktura chlorku sodu, NaCl
Krystaliczna struktura chlorku sodu, NaCl Spryskany cukier i sól (GLA) pozostają krystaliczne; Jego kryształy stały się znacznie mniejsze dla naszych oczu. Dlatego krystaliczność stałego jest zdefiniowana bardziej przez jego wewnętrzną strukturę, niż przez jej wygląd zewnętrzny lub blask.
[TOC]
Struktura krystalicznych ciał stałych
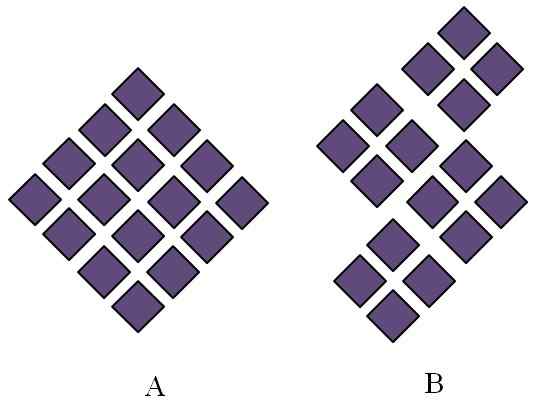 Uporządkowane struktury krystalicznych ciał stałych. Źródło: Gabriel Bolívar.
Uporządkowane struktury krystalicznych ciał stałych. Źródło: Gabriel Bolívar. Krystaliczne stałe zamówiły struktury. Jego cechy geometryczne będą zależeć od rodzaju sieci krystalicznej, do której należą, która z kolei jest rzutowana zewnętrznie w postaci kryształu (układ krystaliczny). Najwyższy obraz ilustruje dwie ważne pojęcia takich struktur: okresowość i ziarna krystaliczne.
Może ci służyć: faza rozproszeniaUkład przestrzenny cząstek krystalicznej substancji stałej jest gazeta; to znaczy, powtarza się to raz po raz we wszystkich kierunkach. Powoduje to własny wzór strukturalny dla każdej sieci stałej i krystalicznej; Na przykład tutaj sól i cukier zaczynają odróżniać poza swoją chemiczną naturą.
W rombach nakazano im powstać romb o większych proporcjach. Każdy fioletowy romb reprezentuje cząstkę lub ich zestaw (atomy, jony lub cząsteczki). Można więc oczekiwać, że makroskopowy kryształ ma wygląd Rhomboédica.
Tymczasem w B rombiny są uporządkowane w taki sposób, że pochodzą one krystaliczne ziarna; Są to bardzo małe kryształy (krystality). Mówi się wtedy, że B jest litymą poliristalową; Oznacza to, że jest tworzona przez aglomerację wiele krystalitów.
Podsumowując, substancja stała może być po prostu krystaliczna (a) lub polyristalan (b); W postaci kryształów, podczas gdy b poliristales.
Nieruchomości
Właściwości krystalicznych ciał stałych zależą od jego rodzaju szkła. Wiadomo, że ich struktury są uporządkowane i że zwykle przedstawiają też genialne frakcje, które zakochują się w miłośnikach minerałów. Jednak wspomniano, że solidne zakurzone, w tym „off”, można również sklasyfikować jako krystaliczne.
Sposób, w jaki ich cząsteczki są zorientowane przestrzennie, pozwala im mieć pewne ważne właściwości dla ich charakterystyki. Na przykład krystaliczne stałe są zdolne do dyfrakcyjności x -kart, tworząc widma dyfrakcyjne, z których można określić mikroskopową strukturę kryształu.
Podobnie, ponieważ struktura jest okresowa, ciepło jest rozpowszechniane w ten sam sposób w całej substancji stałej; Tak długo, jak pomiędzy. Zatem temperatury topnienia dla krystalicznej substancji stałej są stałe i nie różnią się niezależnie od tego, jak są mierzone.
Może ci służyć: galu: właściwości, struktura, uzyskiwanie, użyciaRodzaje krystalicznych ciał stałych
Rodzaje krystalicznych ciał stałych opierają się na tym, jakie typ cząstek to komponują i jakie są ich interakcje lub linki. Istnieją cztery siatki jonowe, metaliczne, molekularne i kowalencyjne.
Nawet gdy przedstawiają pewien stopień zanieczyszczeń, nadal są krystaliczne, chociaż ich właściwości są dotknięte i nie wykazują tych samych oczekiwanych wartości dla czystej stałej.
joński
Sól jest przykładem jonowego krystalicznego ciała stałego, ponieważ składa się z jonów Na+ i Cl-. Dlatego w tego rodzaju substancji stałych rządzi więź jonowa: to siły elektrostatyczne rządzą porządkiem strukturalnym.
Metal
Wszystkie atomy metali tworzą metaliczne kryształy. Oznacza to, że na przykład srebrny widel. Struktura wewnętrzna lub mikroskopijna jest taka sama w każdej dłoni obiektu i pozostaje niezmieniona od uchwytu widelca do czubka zębów.
Molekularny
Cukier jest przykładem molekularnego krystalicznego stałego, ponieważ powstaje cząsteczki sacharozy. Dlatego ten rodzaj stałego składa się z cząsteczek, które poprzez interakcje międzycząsteczkowe (i wiązania niekowalencyjne) zarządzają uporządkowaną strukturą.
Kowalencyjne sieci
Wreszcie, mamy krystaliczne stałe sieci kowalencyjnych. Przeważają wiązania kowalencyjne, ponieważ są odpowiedzialne za ustanowienie zamówienia i utrzymanie atomów silnie ustalonych w odpowiednich pozycjach przestrzeni. Nie mówi się o jonach, atomach ani cząsteczkach, ale o trzech wymiarach sieci.
Przykłady
Następnie, a na koniec kilka przykładów będą cytowane dla każdego z rodzajów krystalicznych ciał stałych.
Może ci służyć: elektroonycznośćjoński
Wszystkie sole są substancjami jonowymi. Istnieją również siarki, wodorotlenki, tlenki, halogendy i inne związki, które są również tworzone przez jony lub ich interakcje są w esencji jonowej. Mamy:
-Kcl
-Sprawa4
-BA (OH)2
-Cuso4
-Fecl3
-Na2S
-MGO
-CAF2
-Nahco3
-(NH4)2Cro4
Oprócz tych przykładów, zdecydowana większość minerałów jest uważana za jonowe krystaliczne stałe.
Metal
Każdy metalowy element jest naturalnie prezentowany jako kryształy metalowe. Niektórzy z nich są:
-Miedź
-Żelazo
-Aluminium
-Chrom
-Metalowy wodór (pod niewyobrażalnymi ciśnieniami)
-Wolfram
-Cyrkon
-Tytan
-Magnez
-Sód
Molekularny
Istnieje wiele różnych stałych krystalicznych molekularnych. Praktycznie każdy związek organiczny, który zestala się, udaje się ustalić kryształy, jeśli jego czystość jest wysoka, lub jeśli jego struktura nie jest zbyt skomplikowana. Więc mamy:
-Lód (h2ALBO)
-Suchy lód (co2)
-Siema2
-P4
-S8 (i jego polimorfy)
-Antracen
-Stały tlen
-Solidny amoniak
-Fenolphtaleina
-Kwas benzoesowy
Kowalencyjne sieci
I wreszcie, wśród niektórych krystalicznych substancji stałych sieci kowalencyjnych mamy:
-Diament
-Grafit
-Nanorurki węglowe
-Fullerenos
-Kwarc
-Krzem
-German
-Azotek boru
Z tej listy nanorurki węglowe i fullerene można również uznać za stałe krystaliczne molekularne. Wynika to z faktu, że chociaż składają się one z kowalencyjnie zjednoczonych atomów węgli, definiują jednostki, które można wizualizować jako makrocząsteczki (piłki piłkarskie i rurki).
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Kryształ. Źródło: w:.Wikipedia.org
- Chemia librettexts. (16 czerwca 2019). Krystaliczne i amorficzne stałe. Odzyskane z: chem.Librettexts.org
- Rachel Bernstein i Anthony Carpi. (2020). Właściwości stałych. Odzyskane z: Visionlearning.com
- « Amorficzna struktura stałych, właściwości, przykłady
- Przyczyny eksplozji demograficznej, konsekwencje, zalety, wady »

