Sole organiczne
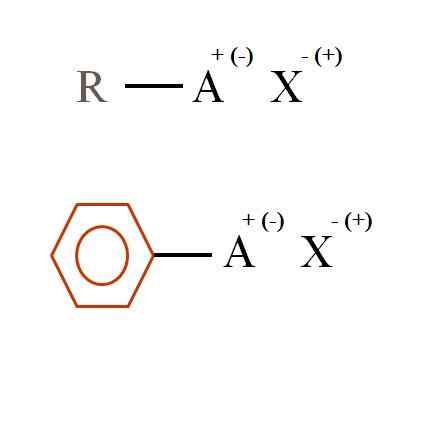
- 3860
- 1112
- Pani Gilbert Stolarczyk
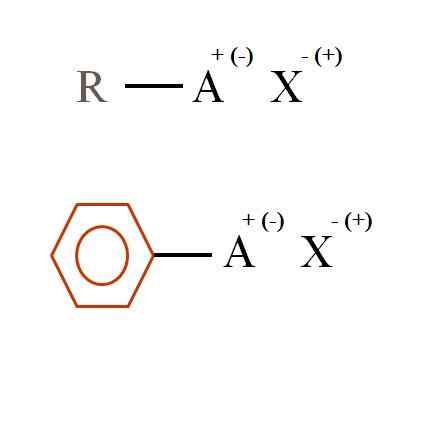 Dwa ogólne wzory chemiczne dla soli organicznych. Źródło: Gabriel Bolívar
Dwa ogólne wzory chemiczne dla soli organicznych. Źródło: Gabriel Bolívar Jakie są sole organiczne?
Sole organiczne Są gęstą liczbą związków jonowych o niezliczonych cechach. Wcześniej pochodzący z związku organicznego, który ulegał transformacji, która pozwala jej być ładunkiem, a jego tożsamość chemiczna zależy od powiązanego jonu.
Na obrazie wyższym pokazano dwa bardzo ogólne wzory chemiczne dla soli organicznych. Pierwszy, R-AX, jest interpretowany jako związek, w którego strukturze węgla atom lub grupa A nosi dodatnie + lub ujemne obciążenie (-).
Jak widać, istnieje kowalencyjna więź między R i A, R-A, ale z kolei ma formalne obciążenie, które przyciąga (lub odpycha) do jonu x. Znak obciążenia będzie zależeć od charakteru A i środowiska chemicznego.
Gdyby było pozytywne, ile x może wchodzić w interakcje? Z jednym, biorąc pod uwagę zasadę elektrooneTralności (+1-1 = 0). Jednak jaka jest tożsamość x? Anion x może być co32-, Wymaganie dwóch kationów RA+; Halogened: F-, Cl-, Br-, itp.; lub nawet inny związek-. Opcje są nieobliczalne.
Podobnie sól organiczna może być aromatyczna, zilustrowana w benzenicznym brązowym pierścieniu. Sól benzoanowa miedzi (i)6H5Gruchać)2Na przykład Cu składa się z dwóch pierścieni aromatycznych z negatywnie załadowanymi grupami karboksylowymi, które oddziałują z kationem Cu2+.
Właściwości fizyczne i chemiczne soli organicznych
Na podstawie obrazu można potwierdzić, że sole organiczne składają się z trzech składników: organicznego, R lub Pierścienia aromatycznego), atomu lub nośnika grupy obciążenia jonowego A i przeciwśrza x.
Podobnie jak tożsamość i struktura chemiczna są zdefiniowane przez takie komponenty, w taki sam sposób, w jaki zależą od nich ich właściwości.
Z tego faktu można podsumować pewne ogólne nieruchomości, które spełniają zdecydowaną większość tych soli.
Może ci służyć: Numer utleniania: koncepcja, jak go wyciągnąć i przykładyMasy o wysokiej cząsteczce
Zakładając mono lub wszechstronne aniony nieorganiczne, sole organiczne zwykle mają znacznie większe masy cząsteczkowe niż sole nieorganiczne. Wynika to głównie z szkieletu gazowanego, którego proste wiązania C-C i jego atomy wodoru zapewniają dużą masę dla związku.
Dlatego są odpowiedzialnymi za ich wysokie masy cząsteczkowe.
Amfifyliczne i środki powierzchniowo czynne
Sole organiczne to związki amfifilowe, to znaczy ich struktury mają zarówno ekstremalne i hydrofobowe ekstremalne, jak i hydrofobowe.
Jakie są takie skrajności? R lub A reprezentują hydrofobowy koniec, ponieważ ich atomy C i H nie mają wielkiego powinowactwa do cząsteczek wody.
DO+(-), Grupa nośnika atomu lub ładunków jest hydrofilowym końcem, ponieważ przyczynia się do momentu dipolowego i oddziałuje z dipolem tworzącym wodę (RA+ Oh2).
Gdy regiony hydrofilowe i hydrofobowe są spolaryzowane, sól amfifilowa staje się środkiem powierzchniowo czynnym, substancją szeroko stosowaną do opracowania detergentów i Unullamping.
Wysokie punkty wrzenia lub fuzja
Podobnie jak sole nieorganiczne, sole organiczne mają również wysokie temperatury topnienia i wrzenia, ze względu na siły elektrostatyczne rządzące w fazie ciekłej lub stałej.
Jednak posiadanie elementu organicznego R lub AR, inne typy van der Waals (Londyn, Dipolo-Dipolo, Wodorowe mosty) w jakiś sposób z elektrostatycznymi.
Z tego powodu stałe lub ciekłe struktury soli organicznych są przede wszystkim bardziej złożone i zróżnicowane. Niektóre z nich mogą nawet zachowywać się jak ciekłe kryształy.
Kwasowość i podstawa
Sole organiczne są zwykle silniejszymi kwasami lub zasadami niż sole nieorganiczne. Wynika to z faktu, że na przykład w sole aminowej ma dodatnie obciążenie ze względu na swój związek z dodatkowym wodorem: a+-H. Następnie, w kontakcie z bazą, ponownie przekazaj proton jako neutralny związek:
Może ci służyć: Strontium: historia, struktura, właściwości, reakcje i zastosowaniaRa+H + B => RA + HB
H należy do a, ale jest napisane, ponieważ interweniuje w reakcji neutralizacji.
Z drugiej strony RA+ Może to być duża cząsteczka, niezdolna do utworzenia ciał stałych o krystalicznej sieci stabilnej z anionem hydroksylowym lub okshydilo OH-.
Kiedy tak jest, solna pamięć+Oh- Zachowuje się jak silna baza; Nawet tak podstawowe jak Naoh lub Koh:
Ra+Oh- + Hcl => racl + h2ALBO
Zwróć uwagę na równanie chemiczne, że anion Cl- Wymień OH-, tworząc sól RA+Cl-.
Zastosowania soli organicznych
Zastosowanie soli organicznych będzie się różnić w zależności od tożsamości R, AR, A i X. Ponadto zastosowanie, do których są przydzielane. Niektóre ogólne w tym zakresie to:
- Służą jako odczynniki do syntezy innych związków organicznych. Rax może działać jako „dawca” łańcucha R, aby dodać do innego związku, zastępując dobrą grupę wychodzącą.
- Są środkami powierzchniowo czynnymi, dzięki czemu można je również stosować jako smary. Do tego celu stosuje się metalowe sole karboksylobelowe.
- Pozwalają na syntetyzację szerokiej gamy barwników.
Przykłady soli organicznych
Karboksylaty
Kwasy karboksylowe reagują z wodorotlenkiem w reakcji neutralizacji, powodując sole karboksyloalanowe: RCOO- M+; gdzie m+ Może to być każde metaliczne kation (na+, Pb2+, K+, itp.) lub kation amonu NH4+.
Kwasy tłuszczowe to długie kwasy karboksylowe, mogą być nasycone i nienasycone. Kwas palmitynowy należą do nasyconych (wybierz3(Ch2)14Cooh). Pochodzi to z soli palmitynitycznej, podczas gdy kwas stearynowy (Cho3(Ch2)16Cooh tworzy sól stear. Mydła są składane z tych soli.
Może ci służyć: ogólne prawo gazoweW przypadku kwasu benzoesowego C, C6H5Cooh (gdzie c6H5- Jest to pierścień benzenowy), gdy reaguje z podstawą tworzy sole benzoesu. We wszystkich karbokoleniach grupy -CO- Reprezentuje (RAX).
Litowe diaquilcupratos
Dzień litu jest przydatny w syntezie organicznej. Jego formuła to [R-CU-R]-Li+, w którym atom miedzi ma obciążenie ujemne. Tutaj miedź reprezentuje atom obrazu.
Sole sulfonowe
Wynikają one z reakcji siarczku organicznego z alkilowym halogenkiem:
R2S + r'X => r2R's+X
W przypadku tych soli atom siarki ma dodatnie obciążenie formalne (s+) Posiadanie trzech kowalencyjnych linków.
Sole oksyio
Podobnie etyki (natlenione analogi siarków) reagują z hydraceidami, tworząc pokoje tlenowe:
ROR ' + HBR RO+HR ' + BR-
Proton kwasu HBR jest konsekwentnie powiązany z atomem tlenu eterowym (r2ALBO+-H), ładując go pozytywnie.
Sole amina
Aminy mogą być pierwotne, wtórne, trzeciorzędowe lub czwartorzędowe, podobnie jak ich sole. Wszystkie z nich charakteryzują się posiadaniem atomu H połączenia z atomem azotu.
Zatem rnh3+X- Jest to pierwotna sól aminowa; R2NH2+X-, wtórnej aminy; R3NH+X-, trzeciorzędowej aminy; i r4N+X-, czwartorzędowej aminy (czwartorzędowa sól amonowa).
Sole diazonium
Wreszcie sole diazonium (RN2+X-lub arildiazonium (RNA2+X-), reprezentują punkt początkowy wielu związków organicznych, zwłaszcza barwników azoickich.
Bibliografia
- Francis a. Szylkret. Chemia organiczna (wydanie szóste, PP. 604-605, 697-698, 924). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. Chemia organiczna. AMINES (wydanie 10.). Wiley Plus.
- Wikipedia (2018). Sól (chemia). Zaczerpnięte z: w.Wikipedia.org
- Steven a. Hardinger (2017). Ilustrowany glosariusz chemii organicznej: sole. Odzyskane z: chem.UCLA.Edu
- Chevron Oronit (2011). Karboksylaty. [PDF]. Odzyskane z: oronitu.com

