Reguła dźwigni
- 1334
- 55
- Arkady Sawicki
Jaka jest zasada dźwigni?
Reguła dźwigni Jest to procedura matematyczna, która pozwala obliczyć ułamki, procent lub ilości faz obecnych w równowadze w systemie binarnym. Jest to nie tylko matematyczne, ale także dość graficzne i asertywne, jest bardzo przydatne w obliczeniach fizykochemicznych i inżynierskich.
Ta zasada dotyczy diagramów fazowych dla systemów binarnych, niezależnie od rodzaju samego systemu. Oznacza to, że fazy mogą być solidne, jak w przypadku stopów; lub ciekłe i gazowe, jak widzimy w układach w równowadze ciekłoboczkowej.
 Fizyczna i matematyczna zasada dźwigni jest również wykorzystywana do celów chemicznych i w fizyce materiałów. Źródło: Jimbowley, CC BY-SA 3.0, Via Wikimedia Commons
Fizyczna i matematyczna zasada dźwigni jest również wykorzystywana do celów chemicznych i w fizyce materiałów. Źródło: Jimbowley, CC BY-SA 3.0, Via Wikimedia Commons Regułę dźwigni można zastosować bezpośrednio, biorąc pod uwagę wartości graficzne w osi odciętej, w których globalne frakcje lub odsetek najbardziej lotnego składnika zwykle idą, w przypadku cieczy; lub oporne, w przypadku metali w ich stopach.
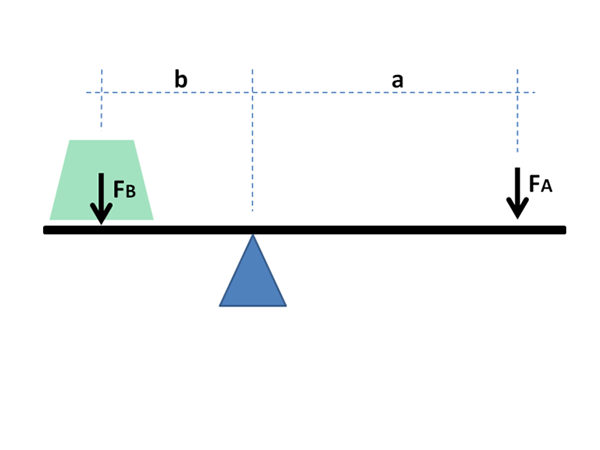
Jak widać poniżej, jego nazwa wynika z ogromnego podobieństwa z wyrażeniami matematycznymi, które pokazują równowagę między dwiema masami znajdującymi się na końcach rockera z Fulcro.
Ramiona dźwigni muszą zrównoważyć, aby zrównoważyć masy obciążeń; W przypadku diagramów fazowych frakcje i mole faz w równowadze materiału.
Wyjaśnienie
Aspekty graficzne
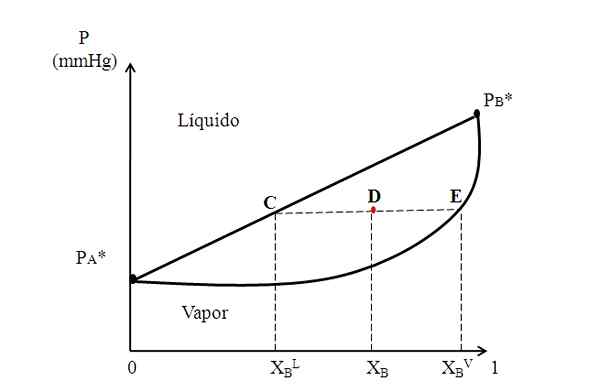 Hipotetyczny schemat binarny, w którym linia wiązania pokazuje skład faz cieczy i parowych. Źródło: Gabriel Bolívar.
Hipotetyczny schemat binarny, w którym linia wiązania pokazuje skład faz cieczy i parowych. Źródło: Gabriel Bolívar. Na środku powyższego schematu mamy region, w którym ciek i pary współistnieją; to znaczy region równowagi ciekłej-prądowej. Powyżej tego regionu mieszanina A i B będzie płynna, a pod spodem będzie soda z powodu niższych ciśnień.
Teraz rozważ mieszaninę ze składem xB i którego ciśnienie jest pozycjonowane w punkcie D. Rysujemy z punktu d poziomą linię, która dotyka linii i krzywej po bokach, odpowiednio, pochodzącymi z punktów C i. Ta linia, która komunikuje punkty C, D i E, C-D-E, jest znaną jako linia Unii, a poprzez rzutowanie jej w kierunku osi i musi dać nam presję systemu.
Może ci służyć: alkaliczność wodna: co to jest, determinacja i znaczenieNastępnie z tych punktów rysujemy inne linie prostopadłe do linii wiązania, która będzie grała w osi x. Gdy punkt E spoczywa na krzywej pary, będziemy mieli frakcję molową B w fazie pary (xBV). Podobnie punkt C, na prostej linii cieczy, da nam frakcję molową B w fazie ciekłej (xBL).
Reguła dźwigni opiera się dokładnie na linii wiązania, a odległości między xBL, XB i xBV.
Odliczenie matematyczne
Globalny frakcja trzonowa B jest równa:
XB = NB / (NL + NV)
Gdzie NB Są to całkowite mole B zarówno w fazie ciekłej, jak i pary, oraz NL I NV są odpowiednie mole dla tych faz. Clearing NB będziemy mieli:
NB = XBNL + XBNV (1)
Z drugiej strony, NB Jest również równy:
NB = NBL + NBV
= XBLNL + XBVNV (2)
Teraz wyrównujące równania (1) i (2) dadzą nam:
XBNL + XBNV = XBLNL + XBVNV
I zmienił:
NL(XB - XBL) = NV(XBV - XB) (3)
NL(C-D) = NV(Z)
Te dwa ostatnie wyrażenia matematyczne są zasadą dźwigni. Zauważ, że xB - XBL Jest to odległość między punktami C i D; i xBV - XB, Jest to odległość między punktami D-E: dwie połowy linii wiązania (ramiona dźwigni).
To równanie jest bardzo podobne do opisu równowagi mas na rockerze z Fulcro:
M1L1 = m2L2
Zatem reguła dźwigni pozwoli nam obliczyć całkowitą mole NL I NV pod warunkiem, że łączne mole mieszaniny są znane, NT (NT = NL + NV).
Druga forma
Poprzednie wyrażenie reguły dźwigni służy do obliczenia ilości (masy, mole itp.) faz w równowadze. Jednak najbardziej znana wersja reguły dźwigni pozwala nam obliczyć ułamki lub procent każdej fazy, przyjmując tylko odległości między xB, XBL i xBV.
Rozważ ten sam system powyżej, mając inną formę zasady dźwigni:
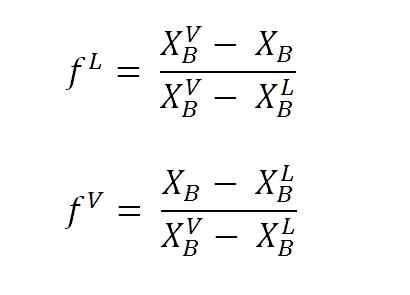 Równania do obliczania frakcji cieczy i parowych za pomocą ramion dźwigni. Źródło: Gabriel Bolívar.
Równania do obliczania frakcji cieczy i parowych za pomocą ramion dźwigni. Źródło: Gabriel Bolívar. Gdzie F L I F VSą to frakcje molowe (lub procent, w zależności od wykresu) odpowiednio faz cieczy i pary. Zauważ, że oczywiście, F L I F V Nie mają jednostek; chwila NL I NV Tak, mają jednostki (mole, gramy itp.).
Może ci służyć: ciepło reakcyjnePrzykłady
Metoda 1
W pojemniku 28 moli B i 12 moli A są mieszane. Określ ilości i frakcje molowe dla tworzonych faz.
Obliczamy xB:
XB = (28 moli b)/ (28 moli b + 12 moli a)
= 0.7
Ta wartość odpowiada xB górnego schematu. Przechwyty dają nam w przybliżeniu następujące wartości dla xBL i xBV:
XBL = 0.41
XBV = 0.94
Z zasadą dźwigni:
NL(XB - XBL) = NV(XBV - XB)
I wiedząc o tym NT = NL + NV, I? NT = 40 moli, a potem oczyszczamy NL albo NV w zależności od drugiego:
NL(XB - XBL) = (40 moli - NL) (XBV - XB)
Przegrupowanie i usuwanie NL będziemy mieli:
NL = (40 moli) (xBV - XB) / (XBV - XBL)
Czy to wyrażenie nie pamięta tego F L? Teraz zastąpimy:
NL = (40 moli) (0.94 - 0.70) / (0.94 - 0.41)
= 18.11 moli w fazie ciekłej
Możemy obliczyć NV Na dwa sposoby:
NV = NL(XB - XBL) / (XBV - XB)
albo
NV = 40 moli - 18.11 moli
= 21.89 moli w fazie pary
Metoda 2
Co jeśli obliczymy najpierw F L I F V?
F L = (XBV - XB) / (XBV - XBL)
= (0.94 - 0.70) / (0.94 - 0.41)
= 0.4528 lub 45.28%
To znaczy 45.2% moli znajduje się w fazie ciekłej, która jest taka równa:
NL = F LNT
= (0.4528) (40 moli)
= 18.11 moli
I F V Możemy obliczyć to jednakowo na dwa sposoby:
F V = 1 - F L
albo
F V = (XB - XBL) / (XBV - XBL)
Będąc jego wartością:
F V = 0.5472 lub 54.72%
I dlatego, NV Będzie to równe:
NV = F VNT
= (0.5472) (40 moli)
= 21.89 moli
Zauważ, że zastosowanie dwóch form reguły dźwigni jako alternatywnych metod obliczeń można osiągnąć te same wyniki. Metoda 2 wydaje się bardziej bezpośrednia i prosta; Ale jeśli jest to obserwowane ostrożnie, po rozwiązaniu wyczyszczenia NL albo NV, Okaże się, że obie metody są w rzeczywistości równie łatwe.
Rozwiązane ćwiczenia
Następnie zostaną rozwiązane dwa inne ćwiczenia, w których rozważane systemy będą obejmować ciekłokrotny i nie-cieczowy. Również diagramy są graficzne w odniesieniu do temperatury systemu, a nie na ich ciśnieniu.
Ćwiczenie 1
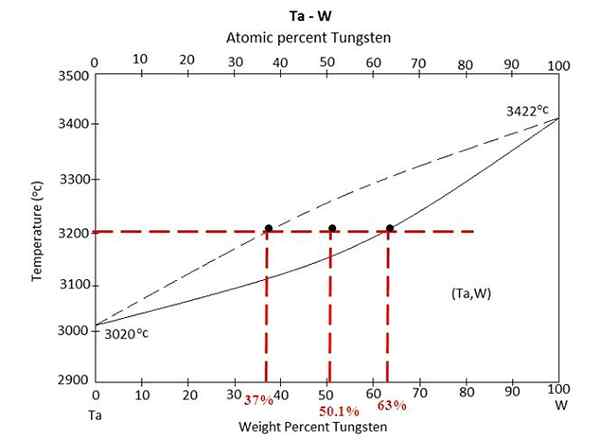 Schemat fazowy stopu między tantalo i wolframem. Źródło: Materialsedia, CC BY-SA 4.0, Via Wikimedia Commons
Schemat fazowy stopu między tantalo i wolframem. Źródło: Materialsedia, CC BY-SA 4.0, Via Wikimedia Commons Mamy schemat fazowy powyżej stopu między tantalo i wolframem, TA-W. Na osi x reprezentowane są globalne masowe odsetki wolframu, W% (m/m).
W obrębie regionu równowagi ciekłej (TA+W) i stałym (stopu) występuje mieszanina w temperaturze 3200 ° C. Określ masy każdej fazy, zakładając, że 100 gramów stopu zostało podgrzanych.
Może ci służyć: metale, nie -metal i metaloidyProcedura
Tym razem ćwiczenie zostanie rozwiązane przy użyciu drugiej formy reguły dźwigni. Linia Unii mówi nam, że: W fazie stałej mamy 63% wolframu, podczas gdy w fazie ciekłej mamy 37% wolframu. Wynika to z faktu, że wolfram topi się w wyższej temperaturze (3422 ° C) niż tantal (3020 ° C).
Więc mamy:
W%S lub wS= 63%
W%L lub wL= 37%
I również:
W0 = 50.1%
Stosujemy zasadę dźwigni F L:
F L = (63% - 50.1%) / (63% - 37%)
= 0.4961 lub 49.61%
Należy zauważyć, że odległość odpowiadająca fazie ciekłej jest ramieniem dźwigni w pobliżu fazy stałej, po przeciwnej stronie punktu średniej.
Masa fazy ciekłej jest zatem:
(0.4961) (100 gramów) = 49.61 stopione gramy
A faza stała będzie równa:
100 gramów - 49.61 gramów = 50.39 gramów stopu bogatego w wolfram
Ćwiczenie 2
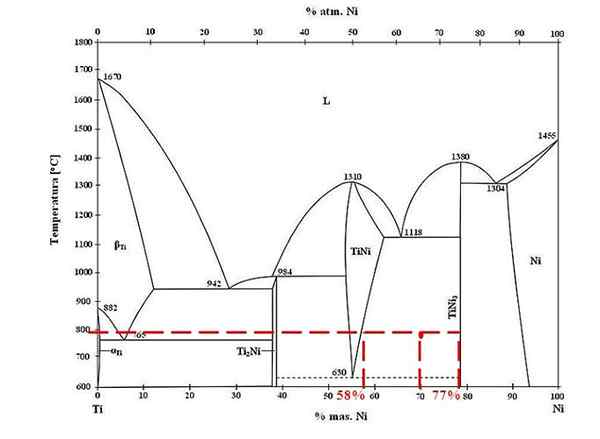 Schemat fazowy stopów tytanowych. Źródło: Doomgiver, CC BY-SA 3.0, Via Wikimedia Commons
Schemat fazowy stopów tytanowych. Źródło: Doomgiver, CC BY-SA 3.0, Via Wikimedia Commons W przypadku stopu tytanu i niklu w temperaturze 800 ° C, a z 70% nikiel3 Są obecne.
Procedura
Tym razem proszą tylko o frakcje masowe każdej fazy. Czerwony punkt znajduje się w obszarze równowagi między fazami tini i tini3, którego krzywe znajdują się tam, gdzie odgrywa linię unii, która przepływa do wartości 58% lub dla fazy tini i 77% lub dla fazy tini3.
Zauważ, że czerwony punkt jest bliżej fazy Tini3 z fazy tini. Oznacza to, że musi być więcej tini3 ten tini; A zatem odległość lub ramię dźwigni odpowiadające tini3 Musi być najdłuższy, odwrotny (70%-58%).
Wiedząc o tym, przystępujemy do obliczania F Tini3:
F Tini3 = (70% - 58%) / (77% - 58%)
= 0.6316 lub 63.16%
Rzeczywiście, 63.16% stopu odpowiada fazie tini3. Tymczasem faza TINI odpowiada:
1 = F Tini3 + F Tini
F Tini = 1 - F Tini3
= 0.3684 lub 36.84%
Podsumowując podniesione ćwiczenia, możemy powiedzieć, że zasada dźwigni jest bardzo pomocna w określeniu ułamków każdej fazy w równowadze dla systemu dwuoskładnikowego.
Bibliografia
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja. MC Graw Hill.
- Wikipedia. (2020). Reguła dźwigni. Źródło: w:.Wikipedia.org
- Michael Adewumi. (18 maja 2020). Zasada dźwigni. Odzyskane z: eng.Librettexts.org
- Adam Warren. (1997). Schematy fazowe: linie remisowe i zasada dźwigni. Odzyskane z: Southampton.AC.Wielka Brytania
- Uniwersytet Cambridge. (2020). Zasada dźwigni. Źródło: doitpoms.AC.Wielka Brytania

