Reakcje egzotermiczne i endotermiczne
- 785
- 166
- Filip Augustyn
 Spalanie jest przykładem reakcji egzotermicznej, ponieważ uwalnia ciepło. Ze swojej strony lód topi się poprzez reakcję endotermiczną, ponieważ wymaga energii cieplnej
Spalanie jest przykładem reakcji egzotermicznej, ponieważ uwalnia ciepło. Ze swojej strony lód topi się poprzez reakcję endotermiczną, ponieważ wymaga energii cieplnej reakcje egzotermiczne i endotermiczne Różnią się faktem, że pierwsze uwalnianie energii cieplnej, podczas gdy te ostatnie ją pochłania, zgodnie ze zmianami ciepła występującymi podczas reakcji chemicznych.
Podobnie, inne rodzaje energii mogą być zaangażowane w reakcje chemiczne, ponieważ czasami podczas reakcji wytwarzana jest energia światła, energia dźwiękowa, a nawet energia elektryczna.
Aby wziąć pod uwagę nie tylko ciepło, ale także inne rodzaje energii, reakcje chemiczne są klasyfikowane jako egzergoniczny I Endermanics. Reakcja egzergoniczna uwalnia energię po wytwarzaniu, podczas gdy endegonika ją pochłania.
W tym przypadku reakcja egzotermiczna jest również reakcją egzergoniczną, ponieważ uwalnia ciepło. Jednym z najbardziej znanych przykładów jest spalanie. Za każdym razem, gdy spalany jest kawałek drewna, uwalniają się kaloryczna i jasna energia.
Z drugiej strony jedna z najlepiej znanych reakcji chemicznych występuje podczas topnienia kostki lodu, ponieważ lód pochłania energię cieplną środowiska, aby przekształcić się w ciekłą wodę.
Reakcja egzotermiczna może wystąpić spontanicznie, chociaż czasami musisz wykonać trochę pracy, aby zacząć. Jednak w celu wystąpienia reakcji endotermicznej, zawsze konieczne jest, aby środowisko wykonało pracę w systemie.
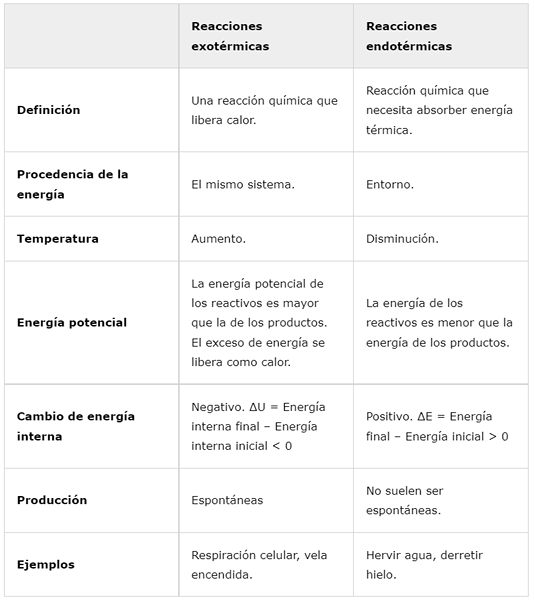
Reakcje egzotermiczne | Reakcje endotermiczne | |
Definicja | Reakcja chemiczna, która uwalnia ciepło. | Reakcja chemiczna, która musi wchłonąć energię cieplną. |
Pochodzenie energii | Ten sam system. | Wokół. |
Temperatura | Zwiększyć. | Zmniejszenie. |
Energia potencjalna | Potencjalna energia odczynników jest większa niż energia produktów. Nadmiar energii jest uwalniany jako ciepło. | Energia odczynników jest mniejsza niż energia produktów. |
Wewnętrzna zmiana energii | Negatywny. ΔU = ostateczna energia wewnętrzna - początkowa energia wewnętrzna < 0 | Pozytywny. ΔE = Energia końcowa - energia początkowa> 0 |
Produkcja | Spontaniczny | Zwykle nie są spontaniczne. |
Przykłady | Oddychanie komórkowe, płonąca świeca. | Gotuj wodę, stopić lód. |
Reakcje egzotermiczne
Definicja
Rodzaj reakcji chemicznej, która uwalnia ciepło, gdy jest przeprowadzane.
Może ci służyć: cyklohexen: struktura, właściwości, synteza i zastosowaniaPochodzenie energii
Ten sam system zapewnia energię, dzięki czemu reakcja nastąpiła.
Temperatura
Po reakcji jest zwiększyć temperatury.
Energia potencjalna
Gdy występuje reakcja chemiczna między odczynnikami, powstają połączenia między nimi a innymi, aby stworzyć nowe cząsteczki. Ale nie wszystkie łącza łączą atomy i cząsteczki z tą samą siłą, dlatego energia do zerwania lub utworzenia każdego łącza jest inna.
Podczas każdej reakcji pękają i tworzą różną liczbę linków, więc energia jest inna. W reakcji egzotermicznej energia potencjalna odczynników jest starszy niż energia produktów, a ponieważ energia jest zachowana, nadmiar jest uwalniany jako ciepło.
Wewnętrzna zmiana energii
Energia wewnętrzna jest związana z zdolnością systemu do wykonywania pracy i obejmuje jego energię potencjalną i energię kinetyczną. Bezwzględna energia systemu nie jest określona, ale jej zmienność, zwana δu.
Zgodnie z tym, co zostało powiedziane w poprzednim rozdziale, zmiana energii wewnętrznej δu jest ujemna.
Δu = końcowa energia wewnętrzna - początkowa energia wewnętrzna < 0
Produkcja
Większość egzotermicznych reakcji to spontaniczny, to znaczy, że mają miejsce dla siebie, bez potrzeby dodawania energii zewnętrznej, dopóki odczynniki nie będą wyczerpane.
Przykłady
Zwykle reakcje utleniania i te, które prowadzą do tworzenia związków, są zwykle reakcjami egzotermicznymi:
1. Rozpuść detergent w wodzie
Kiedy rozpuszcza się pył odzieżowy w odrobinie zimnej wody, czuje się ciepło, gdy go dotyka.
2. Oddychanie komórkowe
U zwierząt i roślin proces oddychania komórkowego jest przeprowadzany w ramach cyklu węglowego. Oddech wykorzystuje glukozę i tlen do zwracania dwutlenku węgla, wody i energii, zgodnie z reakcją:
Może ci służyć: tlenek tytanu (iv): struktura, właściwości, użyciaC6H12ALBO6 + 6th2 → 6co2 + H2O + Energia (ATP)
3. Płonąca świeca
Oprócz światła płonąca świeca oddaje ciepło i inne substancje:
Tlen tlen → woda + dwutlenek węgla + światło i ciepło
4. Bombardujący chrząszcz
Ten owad broni się, posypując aerozol o swoich drapieżnikach. Chrząszcz utrzymuje płyny i enzymy w oddzielnych przedziałach, położone w brzuchu.
Po zagrożeniu wyrzuca płyny w kierunku przedziału enzymu i powstaje reakcja chemiczna, która wytwarza pary i ciepło, działając jako odpychający dla możliwych drapieżników.
5. Wełna stalowa i octu
Metal podobny do żelaza jest powoli utleniony podczas reakcji ze środowiskiem, ale jeśli ocet zostanie dodany do małej wełny stalowej, obserwuje się, że utlenianie jest znacznie szybsze, a jednocześnie generuje ciepło.
Reakcje endotermiczne
Definicja
Reakcje, w których odczynniki muszą pochłaniać energię cieplną, aby uzyskać produkty.
Pochodzenie energii
Energia niezbędna do przeprowadzenia reakcji, przebiega z środowiska.
Temperatura
Reakcja endotermiczna pociąga za sobą zmniejszenie temperatury.
Energia potencjalna
W przeciwieństwie do tego, co dzieje się z reakcją egzotermiczną, energia odczynników To jest mniej że energia produktów.
Wewnętrzna zmiana energii
W reakcji endotermicznej zmiana energii wewnętrznej ΔE jest dodatnia.
ΔE = energia końcowa - energia początkowa> 0
Dlatego energia końcowa jest większa niż początkowa.
Produkcja
Reakcje endotermiczne wymagają wykonania pracy nad systemem, więc zwykle nie są one spontaniczne.
Istnieją jednak pewne reakcje endotermiczne, takie jak topnienie lodu i odparowanie niektórych cieczy, które są spontaniczne w temperaturze pokojowej.
Stwierdzono zatem, że temperatura środowiska jest czynnikiem decydującym w spontaniczności reakcji chemicznej.
Może ci służyć: wskaźniki chemiczne: po co one są, typy, przykładyPrzykłady
Wiele reakcji obejmujących rozpuszczanie soli, a ogólnie, rozkład substancji jest zwykle endotermiczny. W ten sam sposób przejście lodu do ciekłej wody i płynnej wody parowej, to znaczy transformacje stanu, są również reakcjami endotermicznymi.
1. Fotosynteza
Rośliny wykonują reakcję chemiczną w obecności światła słonecznego, w którym przekształcają dwutlenek węgla i wodę w glukozę i tlen. Chlorofil jest kluczową cząsteczką w tym procesie, której reakcją chemiczną jest:
Światło + 6co2 + H2O → c6H12ALBO6 + 6th2
Jak widać, jest to odwrotna reakcja oddychania. Aby wytworzyć kilogram glukozy, potrzebne jest 15 mega dżuli energii słonecznej.
2. Gotuj wodę i gotuj
Bardzo powszechną reakcją, która wymaga energii, jest gotowanie wody:
H2O (ciecz) + energia → H2O (para)
Pokarmy zwykle wymagają wody do gotowania, a w ten sam sposób zawierana przez nich woda musi odparować, aby je ugotować, co wiąże się z zmianą stanu.
3. Stopić lód
Podobnie, lód rozpływa się w temperaturze pokojowej, jeśli jest to większe niż 0 ° C:
H2O (stałe) + energia → h2O (płyn)
Dlatego napój chłodzi przy dodawaniu lodu, ponieważ pochłania energię niezbędną do zmiany stanu z cieczy.
4. Zimne torby
Są używane w leczeniu siniaków i ciosów. Zawierać wodę i obwiednię z chlorkiem amonu. Podczas stukania torby obwiedni jest zepsuta, a reakcja chlorku amonu z wodą, która jest endotermiczna, ochładza torbę i łagodzi ból.
5. Produkcja ozonu
Promieniowanie ultrafioletowe z słońca zamienia tlen w ozon, uwalniając ciepło w tym procesie.
32 (gaz) + światło ultrafioletowe → 23 (gaz)
Bibliografia
- Byju's. Różnica między reakcjami edotermicznymi i egzotermicznymi. Odzyskane z Byjusa.com
- Chang, R. (2013). Chemia. 11va. Wydanie. McGraw Hill Education.
- Grelane. Reakcje egzotermiczne na tematy cieplne. Odzyskane z: Grelane.com.
- Hein, m. (2014). Fundamenty chemii college'u. Wiley.
- Helmestine, a. Zrozumienie reakcji endotermicznych i egzotermicznych. Odzyskane z: Thoughtco.com

