Charakterystyka reakcji i przykłady

- 1927
- 275
- Matylda Duda
A reakcja egzergoniczna Jest to takie, które występuje spontanicznie i ogólnie towarzyszy uwolnienie energii, albo w postaci ciepła, światła lub dźwięku. Po zwolnieniu ciepła mówi się, że mamy do czynienia z reakcją egzotermiczną i egzergoniczną.
Właśnie dlatego terminy „egzotermiczne” i „egzergoniczne” są zdezorientowane, stając się błędnie traktowane jako synonimy. Wynika to z faktu, że wiele reakcji egzotermicznych jest również egzergonicznych. Dlatego, jeśli zaobserwuje się wielki oddział ciepła i światła, na przykład pochodzenie ognia, można założyć, że składa się ono z reakcji egzergonicznej.
 Spalanie drewna jest przykładem egzotermicznej, a jednocześnie reakcji egzergonicznej. Źródło: Pixnio.
Spalanie drewna jest przykładem egzotermicznej, a jednocześnie reakcji egzergonicznej. Źródło: Pixnio. Jednak uwolniona energia może pozostać niezauważona i nie być tak zaskakująca. Na przykład płynne pożywkę może nieznacznie się ogrzewać, a jednak była konsekwencją reakcji egzergonicznej. W niektórych reakcjach egzergonicznych, które przechodzą zbyt wolno, najniższy wzrost temperatury nie jest nawet obserwowany.
Centralnym i charakterystycznym punktem tego rodzaju reakcji termodynamicznych jest spadek energii swobodnej Gibbs w produktach w odniesieniu do odczynników, co przekłada się na spontaniczność.
[TOC]
Charakterystyka reakcji egzergonicznych
Ogólny schemat
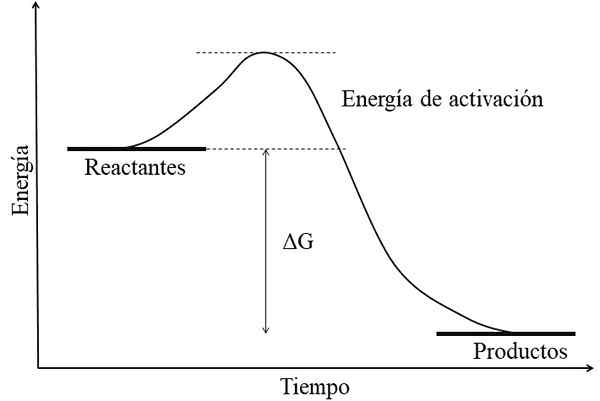 Schemat energii dla reakcji egzergonicznej. Źródło: Gabriel Bolívar.
Schemat energii dla reakcji egzergonicznej. Źródło: Gabriel Bolívar. Główną cechą reakcji egzergonicznej jest to, że produkty mają wolne energie gibs niższe niż reagenty lub odczynniki (obraz doskonały). Fakt ten jest zwykle związany z produktami jest chemicznie bardziej stabilny, z silniejszymi linkami, bardziej dynamicznymi strukturami lub bardziej „wygodnymi” warunkami.
Dlatego ta różnica energii, δG, jest ujemna (gg < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Może ci służyć: jednorodny systemWszystkie te zmienne, które reagują na naturę zjawiska lub rozważana reakcja chemiczna, pozwalają na ustalenie, czy reakcja będzie egzergoniczna. I okaże się również, że niekoniecznie musi to być reakcja egzotermiczna.
Gdy energia aktywacji jest bardzo wysoka, reagenty wymagają pomocy katalizatora w celu zmniejszenia wspomnianej bariery energetycznej. Dlatego istnieją reakcje egzergoniczne, które są podawane przy bardzo niskich prędkościach, lub które w ogóle nie występują.
Bezpłatna energia zmniejsza w systemie
Poniższe wyrażenie matematyczne obejmuje to, co skomentowano powyżej:
ΔG = δH - tΔS
Termin ΔH jest dodatni, jeśli jest reakcją endotermiczną i ujemną, jeśli jest egzotermiczny. Jeśli chcemy, aby Gg był ujemny, termin TΔS musi być bardzo duży i dodatni, tak że podczas odejmowania do Δh wynik operacji jest również ujemny.
Dlatego jest to kolejna szczególna cecha reakcji egzergonicznych: sugerują one dużą zmianę entropii systemowej.
W ten sposób, biorąc pod uwagę wszystkie warunki, możemy być obecni przed reakcją egzergoniczną, ale jednocześnie endotermiczną; to znaczy z δH dodatnie, bardzo wysoka temperatura lub zmiana dużego entropii.
Większość reakcji egzergonicznych jest również egzotermiczna, ponieważ jeśli ΔH jest ujemna, a poprzez odejmowanie innego jeszcze bardziej ujemnego terminu, będziemy mieć ΔG o wartości ujemnej; Chyba że TΔs nie jest ujemny (opada entropia), a zatem reakcja egzotermiczna stałaby się endogoniczna (nie spontaniczna).
Ważne jest, aby podkreślić, że spontaniczność reakcji (zarówno exergonicznej, jak i nie), zależy w dużej mierze od warunków termodynamicznych; Podczas gdy prędkość, z jaką przechodzi, wynika z czynników kinetycznych.
Może ci służyć: żywa materia: koncepcja, cechy i przykładySpontaniczność reakcji egzergonicznej
To, co zostało powiedziane, jest znane, ponieważ reakcja egzergoniczna jest spontaniczna, czy egzotermiczny. Na przykład związek może rozpuścić się w chłodząc wodą wraz z pojemnikiem. Ten proces rozpuszczania jest endotermiczny, ale kiedy dzieje się to spontanicznie, mówi się, że jest egzergoniczny.
Reakcja egzotermiczna
Istnieją reakcje „bardziej egzergoniczne” niż inne. Aby się dowiedzieć, powinno być pod ręką następujące wyrażenie:
ΔG = δH - tΔS
Najbardziej reakcje egzergoniczne to te, które są spontanicznie podawane dla wszystkich temperatur. To znaczy, niezależnie od wartości t w poprzedniej ekspresji, ΔH jest ujemny, a δS dodatni (δH 0). Są zatem bardzo egzotermiczne reakcje, które nie są sprzeczne z początkową ideą.
Mogą również wystąpić reakcje egzotermiczne, w których entropia układu zmniejsza < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Reakcja endotermiczna
Z drugiej strony istnieją reakcje, które są spontaniczne tylko w wysokich temperaturach: gdy ΔH jest dodatnie, a δS dodatni (δH> 0 i δS> 0). Mówimy o reakcjach endotermicznych. Dlatego zjazdy temperatury mogą wystąpić spontanicznie, ponieważ mają one wzrost entropii.
Tymczasem istnieją reakcje, które w ogóle nie są egzergoniczne: gdy ΔH i δs mają wartości dodatnie. W takim przypadku, bez względu na temperaturę, reakcja nigdy nie nastąpi spontanicznie. Mówimy wtedy, o końcowej reakcji endowej.
Może ci służyć: faza rozproszeniaPrzykłady reakcji egzergonicznych
Chemia zwykle charakteryzuje się wybuchem i genialnym, więc zakłada się, że większość reakcji jest egzotermiczna i egzergoniczna.
Spalania
Reakcje egzergoniczne to spalania alkanów, olefin, węglowodorów aromatycznych, cukrów itp.
Metalowe utlenianie
Podobnie, utlenianie metali są egzergoniczne, chociaż przechodzą wolniej.
Reakcje kataboliczne organizmu
Istnieją jednak inne bardziej subtelne procesy, które są również egzergoniczne i bardzo ważne: reakcje kataboliczne naszego metabolizmu. Tutaj makrocząsteczki rozkładają się, które działają jak zbiorniki energetyczne, uwalniając się w upale i ATP, a dzięki temu ciało pełni wiele swoich funkcji.
Najbardziej symbolicznym z tych reakcji jest oddychanie komórkowe, przeciwne do fotosyntezy, w której węglowodany z tlenem są „spalane”, aby przekształcić je w małe cząsteczki (CO2 i H2O) i energia.
Inni
Wśród innych reakcji egzergonicznych mamy wybuchowy rozkład azotu triayoduro, lub3; dodanie metali alkalicznych wodnych, a następnie wybuch; Polimeryczna synteza etoksylowanych żywic; Neutralizację kwasową w roztworze wodnym; i reakcje chemii luminescencyjnej.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja, strona 479-540. MC Graw Hill.
- Wikipedia. (2020). Reakcja egzergoniczna. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (16 września 2019). Reakcja i proces endergoniczny vs exergoniczny. Odzyskane z: Thoughtco.com
- Reakcja egzergoniczna: definicja i przykład. (18 września 2015 r.). Odzyskane z: Study.com
- Khan academy. (2018). Darmowa energia. Odzyskane z: jest.Khan academy.org
- « Mechaniczne wzory energii, koncepcja, typy, przykłady, ćwiczenia
- Zrównoważona konsumpcja dla tego, jakie jest zastosowanie, znaczenie, działania, przykłady »

