Radicals wynajmuje sposób, w jaki tworzą, nomenklatura, przykłady

- 5029
- 170
- Filip Augustyn
Radicals Rent Są zestawem niestabilnych cząsteczek, które pochodzą z utraty hydrogenów alkan. Charakteryzują się znikniętym elektronem, więc szybko reagują, aby ukończyć oktet walencji atomu, w którym się znajduje.
Te rodniki są symbolizowane z literą R, podobnie jak grupy wynajmu, ale z różnicą, że dodano punkt, r ·. Ten punkt wskazuje, że obecność elektronu zniknęła. Rozważmy na przykład gaz metanowy, cho4. Ten alkan, tracący jeden ze swoich hydrogenów, zostanie przekształcony w rodnik metylowy, cho3· (Zdjęcie poniżej).
 Ogólna wzór rodnika alkilu i radykalnego metylu. Źródło: Gabriel Bolívar przez Molview.
Ogólna wzór rodnika alkilu i radykalnego metylu. Źródło: Gabriel Bolívar przez Molview. Jeśli chcesz trochę się pogłębić o radykalnej strukturze CH3· Widać, że jego zniknięty elektron jest pod kątem prostopadłym do łączy C-H; to znaczy znajduje się na orbicie P czysty. Dlatego Cho3· Przyjmij hybrydyzację SP2, a także ogólnie z innymi rodnikami alkilowymi.
Te rodniki są kamieniem węgielnym reakcji łańcuchowych, w których uczestniczą alkan, podobnie jak ich fluorogenacje: chlorowanie, bromation itp. Istnieją 1, 2. i 3. rodniki, a także winyl i alili, każdy z odpowiednią stabilnością i łatwością treningu.
[TOC]
Jak powstają rodniki alkilowe?
„Prostsza” reakcja, dla której powstają rodniki, to fluorogenowanie alkanów. Aby się utworzyć, należy podać reakcję łańcuchową, która występuje tylko w wysokich temperaturach (przekraczająca 250 ° C) lub podczas występowania światła ultrafioletowego w temperaturze pokojowej.
Może ci służyć: siarcze sodu (Na2SO3)Rozważ chlorowanie metanu w jednym z wyżej wymienionych warunków:
Cl2 → 2cl ·
Dostarczona energia wystarczy, aby przełamać łącznik CL-CL cząsteczki chloru, występującą homolityczną przerwę; to znaczy każdy atom chloru pozostaje z jednym z elektronów linków. Dlatego powstają dwa rodniki.
Następnie radykalne Cl · atakuje cząsteczkę metanu:
Cl · + CH4 → HCl + CH3·
I pojawia się radykalny metyl. Ten ch3· Jest dość niestabilny, więc natychmiast zareaguje, aby wygrać dodatkowy elektron, z którym będzie wyglądać na samotny elektron:
Ch3· + Cl2 → CH3Cl + Cl ·
Utworzony będzie reagował z inną cząsteczką metanu, a cykl będzie powtarzany wielokrotnie. Gdy metan się kończy, nastąpi następujące reakcje, które zakończą reakcję łańcuchową:
Cl · + · Cl → Cl2
Ch3· + · Cho3 → CH3Ch3
Ch3· + · Cl → CH3Cl
Stabilność względna
Ch3
Metan nie jest jedynym alkanem, który jest „radykalizowany” przez chlorowanie. Zdarza się to również z etanem, propanem, butanem i innymi izomerami. Jednak różni się niezbędna energia, którą należy dostarczyć, aby rodniki cl · odwodniały cząsteczkę alkan. W przypadku rodnika metylowego jest bardzo niestabilny, a zatem trudny do utworzenia.
Tak więc radykalny cho3Ch2· Jest bardziej stabilny i łatwy w sformułowaniu niż Cho3·. Ponieważ? Ponieważ radykalny ch3Ch2· Jest pierwotna, 1st, co oznacza, że zniknięty elektron jest na atomie węgla, który jest powiązany z innym węglem. Tymczasem Cho3Gdy tylko jest powiązany z atomami wodoru.
Może ci służyć: fluor: historia, właściwości, struktura, uzyskiwanie, ryzyko, zastosowaniaO czym to jest? Pamiętając o poprzedniej reprezentacji, zniknięty elektron znajduje się na orbicie P, prostopadle do innych linków. W rozdz3· Atomy wodoru ledwo przekazują gęstość elektroniczną atomowi węgla, próbując zrekompensować brak innego elektronu.
1st
W rozdz3Ch2· Z drugiej strony węgiel z znikniętym elektronem jest powiązany z dwoma hydrogenami i grupą metylową. W związku z tym węgiel ten otrzymuje większą gęstość elektroniczną, co pomaga ustabilizować elektron zniknął nieco. To samo wyjaśnienie jest ważne dla innych pierwszych rodników alkynd.
2
W radykalnym wtórnym lub 2. alquilu, takim jak radykalne izopropilowe (CH3)2C. Dlatego jest bardziej stabilny niż 1st i rodniki metylowe.
3
Mamy również rodniki trzeciorzędowe lub trzecie alkyndy3)3C ·. Są bardziej stabilne niż 1 i 2. Teraz istnieją trzy grupy gazowane od atomu wodoru, które stabilizują zniknięty elektron.
Allile i winyl
Warto również wspomnieć o radykałach allylowych, Cho2= CH-CH2· I winyl, cho2= CH ·.
Alili jest najbardziej stabilne ze wszystkich. Wynika to z faktu, że zniknięty elektron może nawet przejść do atomu węgla drugiego końca. Z drugiej strony Vínilico jest najbardziej niestabilny ze wszystkich, od czasu grupy Cho2=, więcej kwasu, przyciąga do siebie gęstość elektroniczną zamiast przekazywania go na węgiel z zniknięciem elektronu.
Może ci służyć: wodorotlenek ołowiu: struktura, właściwości, zastosowania, ryzykoPodsumowując, względna stabilność rodników alkynów, od najwyższych do najniższych, to:
Alilo> 3rd> 2nd> 1st> winyl
Nomenklatura
Nomenklatura rodników alkil jest taka sama jak w przypadku środka zaradczego. Zatem Cho3Ch2· Nazywa się radykalną etylową; i radykalne ch3Ch2Ch2Ch3, N-butyl.
Główne radykałki czynsz
Główne rodniki alkilowe pokrywają się z grupami alkilowymi: są to te, które mają mniej niż sześć atomów węgla. Dlatego rodniki pochodzą z metanu, etanu, propanu, butanu i pentano, są najczęstsze. Podobnie, radykalne winyl i aliliki są częścią tej listy.
Inne rodniki alkyndowe, które występują rzadziej, to te, które pochodzą z cykloalcanos, takie jak cyklobutan, cyklobutan lub cyklopentano.
Na poniższym obrazie kilka z tych rodników jest reprezentowanych przy przypisanych literach:
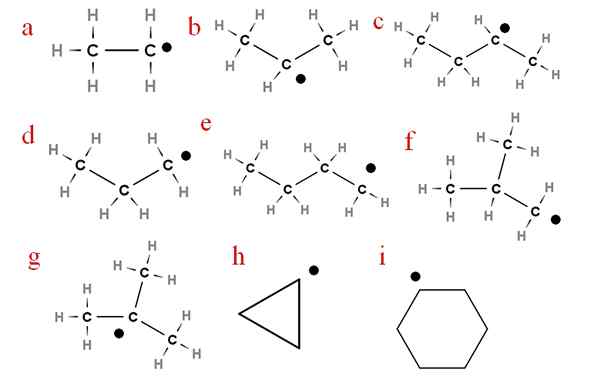 Dziewięć najważniejszych rodników alchery. Źródło: Gabriel Bolívar.
Dziewięć najważniejszych rodników alchery. Źródło: Gabriel Bolívar. Począwszy od litera „A”, mamy:
-a, rodnik etylowy
-B, rodnik izopropylowy
-C, secbutyl rodnik
-D, radykalny propyl
-E, radykalne N-butyl
-F, radykalne izobutil
-G, Ter-butylowe rodniki
-H, radykalny cykropilus
-I, radykalny cykloheksil
Każdy z tych rodników może, ale nie musi, wymienić swoje hydrogen.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Alkil. Źródło: w:.Wikipedia.org
- Chemia librettexts. (5 czerwca 2019). Struktura rodników alkilowych: hiperkonjugacja. Odzyskane z: chem.Librettexts.org
- « Koncepcja odniesień do koncepcji, funkcje, przykłady
- Charakterystyka zwierząt wodnych, oddychanie, typy, przykłady »

