Charakterystyka białka kuliste, struktura, przykłady
- 4441
- 1133
- Eliasz Dubiel
Białka kuliste Są to białka, które mają trzeciorzędową strukturę, w której łańcuchy peptydowe są ustalane w wyglądzie kulisowym. Wiele białek komórkowych odpowiada tej grupie, białka z aktywnością enzymatyczną są najważniejsze.
Białka reprezentują bardzo szczególny rodzaj cząsteczek w komórkach, które tworzą wszystkie żywe istoty. Jego struktura składa się z kombinacji 20 aminokwasów, które są powtarzane w różnych proporcjach i które wiążą się ze sobą poprzez powiązania chemiczne, w genetycznie określonej kolejności lub sekwencji.
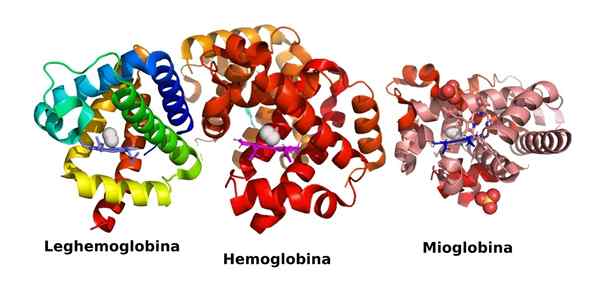 Struktura trzech globularnych białek, które transportują tlen: leghemoglobina, hemoglobina i mioglobina (Źródło: Veronica Stafford/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Via Wikimedia Commons)
Struktura trzech globularnych białek, które transportują tlen: leghemoglobina, hemoglobina i mioglobina (Źródło: Veronica Stafford/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Via Wikimedia Commons) Są wyjątkowo obfite i pełnią niezbędne funkcje z wielu punktów widzenia życia komórkowego, w takim stopniu, że bez nich istnienie życia, jakie wiemy, nie byłoby to możliwe.
Każdy gatunek życia na Ziemi ma określony zestaw białka i, więcej.
[TOC]
Białka kuliste i włókniste
Naukowcy poświęcone badaniu białek tradycyjnie klasyfikowali je zgodnie z wieloma parametrami, ale jednym z najważniejszych jest struktura. Zatem, zgodnie z trójwymiarową strukturą, którą przyjmują, białka mogą być włókniste lub kuliste.
Białka włókniste to te, które mają wydłużony wygląd, ponieważ ich łańcuchy peptydowe są ogólnie równoległe do siebie. Białka te mają wiele funkcji, ale najważniejsze mają związek ze strukturą, wsparciem i biomechaniką komórkową.
Dwa klasyczne przykłady białek włóknistych w ludzkim ciele i innych zwierzętach to keratyna i kolagen, które uczestniczą w tworzeniu włosów i paznokci (pierwsza) i skóry, kości i ścięgien (ostatnia).
Z drugiej strony białka kuliste to białka, które mają bardziej zaokrągloną lub sferyczną trójwymiarową konformację, więc mogą wydawać się nieco bardziej zwarte i nieregularne. Te białka nie uczestniczą bezpośrednio ze struktury komórkowej, ale mają podstawową rolę funkcjonalną.
Może ci służyć: taksiszm Struktura hemoglobiny
Struktura hemoglobiny Przykładami białek kulistych są białka o aktywności enzymatycznej (enzymy), takie jak hemoglobina, który uczestniczy w transporcie tlenu przez krew i Immunoglobuliny, Ta praca w układzie odpornościowym ssaków.
Charakterystyka białek kulistych
Rozpuszczalność
Białka kuliste są częściowo rozpuszczalne w wodzie, aspekt o wielkim znaczeniu, ponieważ są one naprawdę obfite w wodnym środowisku cytosolu i światła różnych organelli komórkowych, gdzie wykonują swoje funkcje.
Struktura
Podczas gdy białka włókniste prawie zawsze powstają przez powtarzalny rodzaj struktury wtórnej, białka kuliste są bardziej heterogeniczne, ponieważ charakteryzują się prezentacją w swoich łańcuchach peptydowych Różne typy struktur wtórnych, które składają się nawzajem.
Funkcje
W grupie białek kulistych są enzymy, duża ilość białek transportowych, białka regulacyjne, białka motoryczne i wiele innych, więc jest to bardzo zróżnicowana grupa, zarówno z punktu widzenia struktury i wielkości, jak i funkcji, jak i funkcji, jak i funkcji, jak i funkcji, jak i funkcji, jak i funkcji, jak i funkcji.
Struktura
Oprócz tego, że białka włókniste jest prawdą, wszystkie informacje niezbędne do osiągnięcia składanej i strukturalnej konformacji białek kulistych są określane przez sekwencję aminokwasową, która z kolei zależy od informacji zawartych w genach, które je kodują, kodują je.
Klasyfikacja
Zasadniczo białka te są klasyfikowane zgodnie z ich funkcją, a każda kategoria jest również podzielona na wiele podkategorii. Dobrym przykładem tego jest klasyfikacja enzymów, która jest obecnie oparta na rodzaju reakcji, w której uczestniczą.
Struktura białek kulistych
Białka kuliste są zdefiniowane jako takie dzięki natywnej konformacji ich trzeciorzędowych struktur, w których łańcuchy aminokwasowe są zakwaterowane, tworząc stosunkowo sferyczną strukturę, zwykle tapicerowaną hydrofilowymi aminokwasami (które oddziałują z wodą), które chronią bardziej hydrofobowe jądro ( który nie wchodzi w interakcję z wodą).
Może ci służyć: czynnik martwicy nowotworów (TNF): struktura, mechanizm działania, funkcjaStruktura pierwotna i wtórna
Podobnie jak białka włókniste, białka kuliste mają podstawową strukturę utworzoną przez liniowy łańcuch aminokwasów, które je tworzą, które są zakwaterowane w śmigierze alfa lub arkuszach beta, co daje strukturę wtórną.
Struktura trzeciorzędowa i czwartorzędowa
Trzeciorzędowa struktura białek kulistych powstaje spontanicznie i jest utrzymywana przez interakcje między łańcuchami aminokwasowymi, które je tworzą.
Jest to kompaktowa i pół -skorupa konformacja, tak zwarta, że przypomina konflikt kryształu. Jest to określone przez interakcje między różnymi strukturami wtórnymi, które mogą znajdować się w tym samym łańcuchu polipeptydowym.
Ustalono, że siły, które utrzymują interakcję między tymi łańcuchami, są zwykle słabe, takie jak interakcje van der waals między najbardziej hydrofobowymi aminokwasami (wiązaniami apolarnymi) lub jako mosty wodorowe między najbardziej hydrofilowymi aminokwasami (łącze polarne (polarne (polarne (polarne (polarne (polarne powiązania (polarne powiązania (polarne powiązania (polar linki).
Ponadto wiele białek kulistych, szczególnie dużych, ma różne „płaty” lub „domeny”, które mogą mieć różne funkcje w tej samej cząsteczce.
Podobnie niektóre białka kuliste występują w naturze jako duże kompleksy białkowe, które składają się z dyskretnych (oddzielnych) łańcuchów polipeptydowych, znanych również jako Podpoważności, Mówi się więc, że są to białka ze strukturami czwartorzędowymi.
Przykłady białek kulistych
Istnieje wiele przykładów białek kulistych, niektóre niezbędne dla komórkowych i innych nie tak bardzo, ale w takim przypadku zawsze jego struktura jest związana z jego funkcją.
Na poziomie komórkowym możemy zatem mówić o niektórych białkach, które uczestniczą w najważniejszych szlakach metabolicznych, takich jak:
HEgzochinaza
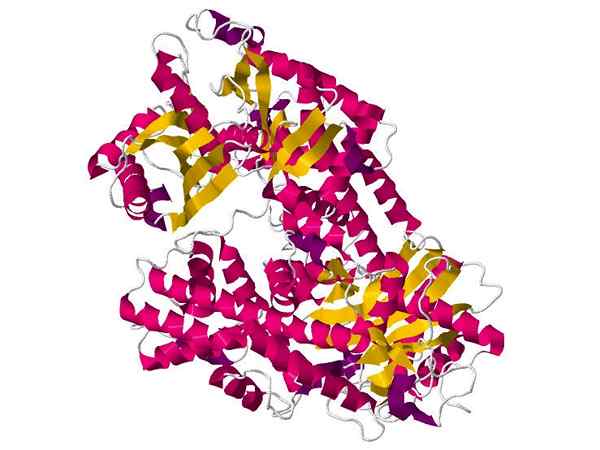 Heksochinaza
Heksochinaza Jest to stosunkowo małe białko kuliste, które występuje w prawie wszystkich żywych komórkach, gdzie jest odpowiedzialne za katalizowanie reakcji fosforylacji odpadów glukozy w pierwszej części trasy glikolitycznej.
SDehydrogenaza uccinato
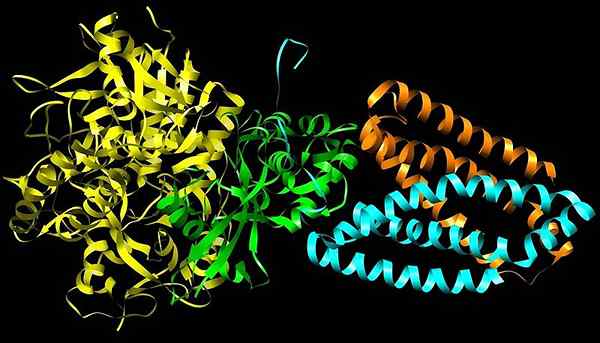 Wielka dehydrogenaza
Wielka dehydrogenaza Jest to mitochondrialny kompleks białkowy, który składa się z czterech podjednostek (A-D) i który uczestniczy zarówno w cyklu kwasu trikarboksylowego (cykl KREBS), jak i w łańcuchu przenośników elektronów, dwóch podstawowych procesów produkcji energii komórkowej w postaci ATP.
Może ci służyć: czynniki biotyczne i abiotyczne dżungliW ludzkim ciele i na innych zwierzętach istnieją również inne bardzo ważne białka, takie jak hemoglobina i immunoglobuliny.
HEmoglobin
 Hemoglobina
Hemoglobina Jest, podobnie jak dehydrogenaza bursztynianowa, białko kuliste o strukturze czwartorzędowej, ponieważ powstaje dwie pary różnych podjednostek, znane jako łańcuchy alfa i łańcuchy beta. Znajduje się w czerwonych krwinkach, gdzie uczestniczy w transporcie tlenu do tkanek.
MIoglobina
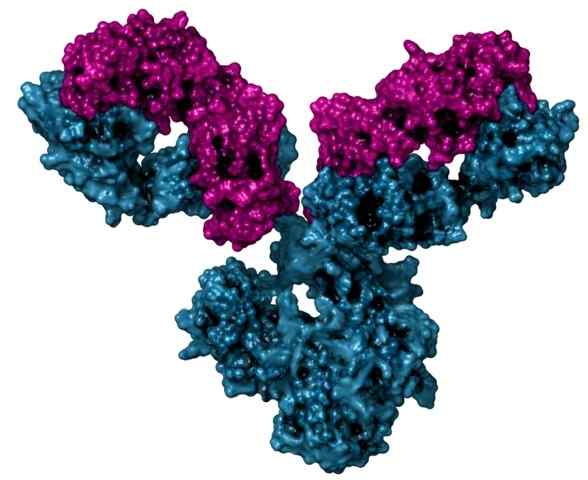 Struktura immunoglobuliny, zwana również przeciwciałem
Struktura immunoglobuliny, zwana również przeciwciałem Jest to również białko kuliste, które wiąże się z tlenem, ale ma to tylko strukturę trzeciorzędową i występuje wyłącznie w komórkach mięśni szkieletowych zwierząt kręgowców.
Siemanmunoglobulin
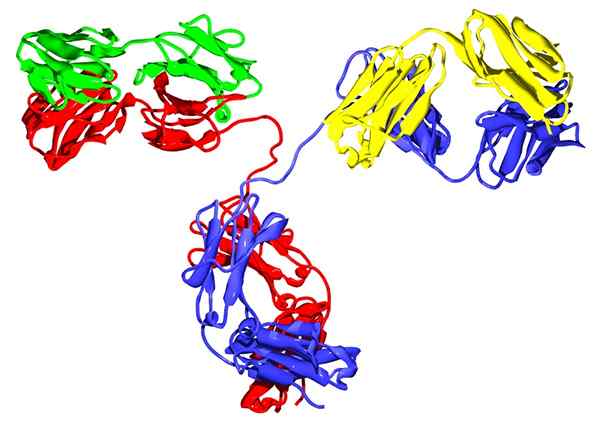 IgG2 immunoglobulina
IgG2 immunoglobulina Są to kuliste glikoproteiny obecne u wielu zwierząt, szczególnie we krwi, limfie i naczyniowych tkankach, gdzie ćwiczą jako członków układu odpornościowego.
Oprócz dehydrogenazy hemoglobiny i bursztynianu, białka te mają strukturę czwartorzędową, ponieważ powstają dwie pary podjednostek: dwa ciężkie łańcuchy i dwa łańcuchy lekkie.
Aquaporin
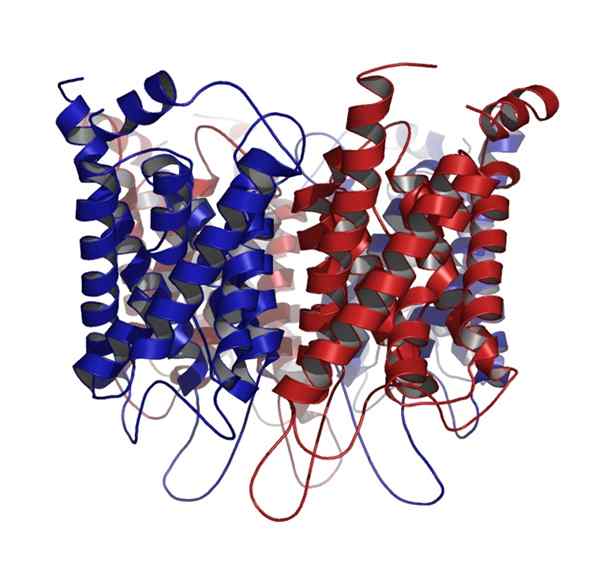 Aquaporin
Aquaporin Innym białkiem kulkowatym, powszechnym w komórkach zwierzęcych i roślin, jest białko, które tworzy kanały błonowe do transportu wody, lepiej znane jako Aquaporin.
Akwaporyny są klasyfikowane jako białka kuliste, ale są to kompleksowe białka błonowe, które są ustalane w strukturach czwartorzędowych utworzonych przez kilka identycznych podjednostek.
Bibliografia
- Chan, h. S., & Dill, k. DO. (1990). Początki struktury w białkach kulistych. Materiały z National Academy of Sciences, 87 (16), 6388-6392.
- Gatunted, k., & Prossa, s. (2007). Immunoglobuliny.
- Gromiha, m. M. (2010). Białko bioinformatyczne: od sekwencji do funkcjonowania. Academic Press.
- Gromiha, m. M., Nagarajan, r., & Sailvaraj, s. (2019). Bioinformatyczne białko strukturalne: przegląd.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Verkman a. S. (2013). Aquaporiny. Obecna biologia: CB, 23 (2), R52-R55. https: // doi.Org/10.1016/j.Młode.2012.jedenaście.025

