Typy proteolizy i funkcje
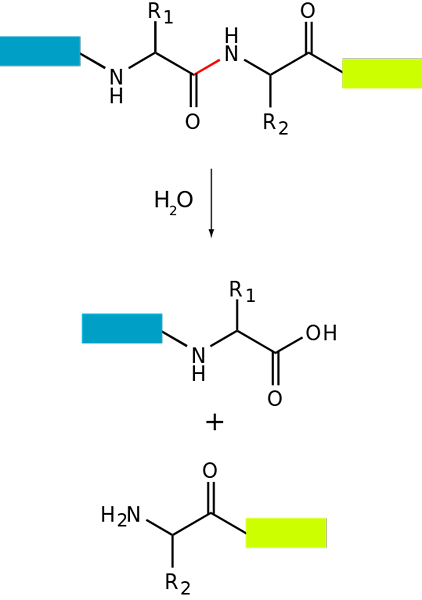
- 3644
- 696
- Eliasz Dubiel
Proteoliza Degradacja białka o jest procesem, w którym białka komórkowe mogą być całkowicie zdegradowane (nawet ich składowe aminokwasy) lub częściowo (wytwarzające peptydy). Oznacza to, że składa się z hydrolizy jednego lub większej liczby powiązań peptydowych, które utrzymują swoje aminokwasy razem.
Proces ten może wystąpić dzięki udziałowi innych białek z aktywnością enzymatyczną, których aktywne miejsca występują hydroliza linków. Może również wystąpić za pomocą „metod” nieenzymatycznych, takich jak działanie ciepła lub substancji o ekstremalnym pH (bardzo kwaśne lub bardzo podstawowe).
 Podstawowy schemat proteolizy białka (źródło: fdardel [CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Podstawowy schemat proteolizy białka (źródło: fdardel [CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Degradacja białka występuje zarówno u bakterii, jak i roślin, ale jest to szczególnie powszechne u zwierząt, szczególnie na poziomie układu trawiennego, ponieważ zależy to od trawienia i wchłaniania jelit białek połkniętych dietetyką.
Ponadto proteoliza ma ogromne znaczenie dla utrzymania funkcjonalnego i regulacji wielu procesów komórkowych, a także ma związek z eliminacją białek, które mają translację, fałdowanie, opakowanie, import, operację itp.
Należy zauważyć, że jest to nieodwracalny, niezwykle skuteczny proces, który działa również w „regulacji regulatorów”, ponieważ nie tylko eliminuje te białka, które mają „bezpośrednie” aktywność biologiczną, ale także te, które regulują inne białka lub ekspresję lub w ekspresji ekspresji lub w ekspresji ekspresji odpowiednich genów.
[TOC]
Rodzaje proteolizy
Wewnętrzne białka komórki można losowo lub selektywnie degradować lub, co jest równe, kontrolowane lub nie. Z kolei, jak wspomniano wcześniej, proces ten może wystąpić przez specjalne enzymy lub ze względu na warunki środowiskowe zdefiniowane jako kwaśne i/lub alkaliczne pH.
Może ci służyć: tkanka powlekania nabłonkaWażne jest, aby wspomnieć, że każde odpowiednio przetłumaczone białko, złożone lub pakowane ukrywa jedną lub więcej sekwencji sygnałów degradacji, które są „tajemnicze” i które można odsłonić, gdy białko jest strukturalnie zaburzone przez temperaturę, pH, pH itp.
Proteoliza ubikwitynacji
Ubikwitynacja (układ ubikwityn-białko) to system, w którym białka można selektywnie hydrolizować po tym, jak zostały one wyraźnie oznaczone do degradacji, proces, który może wystąpić zarówno w cytosolu, jak i w jądrze komórkowym.
Ten system ma zdolność rozpoznawania i niszczenia białek oznaczonych w jądrze i cytosolu, a także degradując białka, które nie składają się poprawnie podczas translokacji z cytosolu do siatkówki endoplazmatycznej.
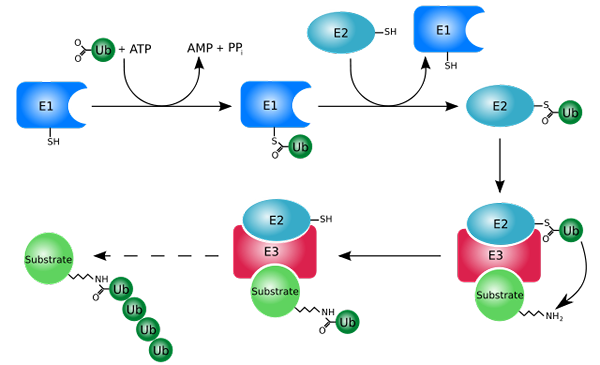 Proces oznaczania za pomocą ubiquitinas (ubiquitination) (Źródło: Rogerdodd [CC BY-SA (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons)
Proces oznaczania za pomocą ubiquitinas (ubiquitination) (Źródło: Rogerdodd [CC BY-SA (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons) Działa głównie przez dodanie lub sprzężenie „białych” białek do małego białka lub peptydu z 76 odpadów aminokwasowych, lepiej znanych jako ubikwityna. Te „oznaczone” białka przez ubikwitynację są degradowane w małych fragmentach przez proteosom 26S, proteazę kilku podjednostek.
Proteoliza autofagii
Autofagia jest również uważana przez niektórych autorów za formę proteolizy, z rozróżnieniem, że występuje to w zamkniętej przedziale błony, skierowanej do lizosomów (w komórkach zwierzęcych), gdzie białka zawarte w środku są degradowane przez proteazy lizosomalne.
Proteoliza nieenzymatyczna
Temperatura, pH, a nawet stężenie soli pożywki mogą powodować hydrolizę wiązań peptydowych, które utrzymują aminokwasy różnych rodzajów białek, które występują przez destabilizację i przerwanie połączeń.
Funkcje
Proteoliza ma wiele funkcji w żywych organizmach. Szczególnie ma to związek z zastąpieniem białka.
Może ci służyć: Ribosomas: Charakterystyka, typy, struktura, funkcjeBiałka mają pół życia, która waha się od kilku sekund do kilku miesięcy, a produkty ich degradacji, czy to regulowane, czy nie, za pośrednictwem enzymów, czy nie, są one na ogół ponownie wykorzystywane do syntezy nowych białek, które prawdopodobnie spełniają różne funkcje.
Tak dzieje się z białkami spożywanymi żywnością, które są degradowane w przewodzie pokarmowym przez proteazy, w tym tripsin i pepsyna; a także z niektórymi białkami komórkowymi, gdy komórki nie mają wystarczającej ilości pokarmu, aby przetrwać.
Wewnątrzkomórkowe układy proteolityczne wykrywają i eliminują „nieprawidłowe” białka, które są potencjalnie toksyczne dla komórek, ponieważ mogą oddziaływać z „niewłaściwymi” ligandami, oprócz wytwarzania agregatów, które powodują impedymenty mechaniczne i fizyczne dla normalnych procesów komórkowych.
Akumulacja nieprawidłowych białek wewnątrz wnętrza komórek, albo z powodu defektów wewnętrznego układu proteolitycznego lub z innych powodów, jest to, co wielu naukowców uważa za jedną z głównych przyczyn starzenia się w żywych istotach wielokomórkowych.
W układzie odpornościowym
Częściowa proteoliza wielu białek ze źródeł egzogennych lub obcych, takich jak inwazja mikroorganizmów, na przykład jest fundamentalnym procesem systemu odpowiedzi immunologicznej, ponieważ limfocyty T rozpoznają krótkie fragmenty, produkt proteolizy (peptydów), które są im prezentowane w związku z tym, że są im w związku z powiązaniem z nimi w związku z tym, że w związku z nimi są prezentowane z proteolizą (peptydami). Zestaw białka powierzchniowego.
Te peptydy mogą pochodzić z układu ubikwitynacji, procesów autofagicznych lub nie kontrolowanych zdarzeń proteolizy.
Inne funkcje
Inną funkcją ograniczonej lub częściowej proteolizy jest modyfikacja nowo utworzonych białek, która funkcjonuje jako „przygotowanie” dla jego funkcji wewnątrztracomórkowych. Jest to prawdą na przykład w przypadku niektórych hormonów i białek zaangażowanych w różne procesy metaboliczne.
Może ci służyć: limffaopoyeza: cechy, etapy, regulacjaZaprogramowana śmierć komórkowa (apoptoza) zależy również w dużym stopniu od proteolizy „specyficznej dla miejsca”, ograniczonej lub częściowej białek wewnątrzkomórkowych, za pomocą których pośredniczy wodospad specyficznych proteaz zwanych kaspazami.
Systemy regulacji zewnątrzkomórkowej zależą również od proteolizy specyficznej dla miejsca, a najwybitniejszym przykładem jest krzepnięcie krwi.
Ogólna lub pełna proteoliza również spełnia podstawowe funkcje selektywnej degradacji tych białek, których stężenie musi być starannie kontrolowane w zależności od stanu fizjologicznego, metabolicznego lub rozwoju komórek.
W roślinach
Rośliny wykorzystują również procesy proteolityczne do kontroli wielu aspektów fizjologicznych i rozwojowych. Działa na przykład w utrzymaniu warunków wewnątrzkomórkowych i w mechanizmach reakcji na stresujące warunki, takie jak susza, zasolenie, temperatura, między innymi.
A także u zwierząt, proteoliza warzyw. W tych organizmach proteoliza przez ubikwitynację jest jednym z najważniejszych.
Bibliografia
- Alberts, ur., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… I Walter, P. (2013). Niezbędna biologia komórki. Garland Science.
- Maurizi, m. R. (1992). Proteaseses i degraion białka w Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Regulowana degradacja białka. Trendy w naukach biochemicznych, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteoliza w roślinach: mechanizmy i funkcja. W kontroli post-transkrypcyjnej ekspresji genów w roślinach (PP. 275-302). Springer, Dordrecht.
- Wolf, d. H., & Messen, r. (2018). Mechanizmy regulacji komórek, wielka niespodzianka. Listy FEBS, 592 (15), 2515-2524.
- « Paradise Ave Charakterystyka, siedlisko, właściwości, reprodukcja, opieka
- Charakterystyka Trypanosoma cruzi, cykl życia, choroby, objawy »

