Charakterystyka proteinazy K, aktywność enzymatyczna, zastosowania
- 1858
- 406
- Matylda Duda
proteina k Jest to enzym, który należy do grupy proteaz serynowych, to znaczy w aktywnym centrum katalitycznym aminokwasem serynowym i ma funkcję rozbijania wiązań peptydowych przez hydrolizę. Z kolei ten enzym należy do rodziny białek subtilisinowych (peptydaza S8).
Proteinaza K ma masę cząsteczkową (PM) 28.900 daltonów i po raz pierwszy izolowano w 1.974 w grzybach wyciągów Album Engyodontium, wcześniej znany jako nazwa Album TriTirachium Limber.
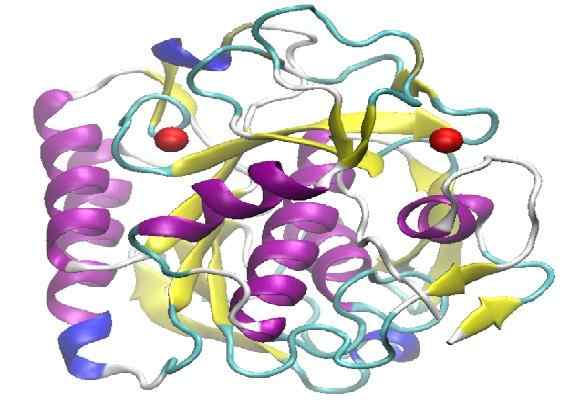
 Struktura molekularna proteinazy K. Źródło: Lykchiniadis [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Struktura molekularna proteinazy K. Źródło: Lykchiniadis [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Przedstawia wysoką zdolność proteolityczną, wykazaną przez możliwość degradacji keratyny obecnej we włosach. Słowo keratyna w języku angielskim jest napisane „keratyna”, stamtąd przychodzi, że nazywano ją „proteinsa k”.
Ze względu na wysoką moc dzielenia natywnych białek enzym jest przydatny w różnych technikach biologii molekularnej. Głównie stosowane do izolowania i przygotowywania kwasów nukleinowych o wysokiej masie cząsteczkowej (PM).
Proteinaza K działa poprzez uwalnianie jądrowego DNA, jednocześnie niszcząc białka i nieaktywne do RNazy i dnate, to znaczy eliminuje nukleaz w preparatach DNA i RNA.
Z drugiej strony zaobserwowano, że Krotek K może hydrolizować niektóre denaturowane rodzime białka, które zainteresowało naukowców do zastosowania w badaniu białek prionowych (PRPC).
Jednak pomimo jego wysokiej mocy proteolitycznej istnieją białka odporne na działanie białka k. Wśród nich istnieją pewne anomalne białka zwane prionami (PRPSC), związane z przenoszonymi gąbczastymi encefalopatiami.
[TOC]
Charakterystyka proteinazy k
Proteinaza K ma trzeciorzędową strukturę składającą się z trzech warstw, z arkuszem β siedmiu łańcuchów medycznych między dwiema warstwami śmigieł. Ponieważ należąca do rodziny peptydaz S8 charakteryzuje się przedstawieniem triady katalitycznej w jej aktywnym miejscu, którego kolejność sekwencyjna jest (asp, jego i istnienie), co odróżnia je od innych rodzin peptydazy.
Może ci służyć: aminokwasy białkoweTen enzym grupy proteazy serynowej charakteryzuje się hydrolizującymi wiązaniami peptydowymi zbliżonymi do grupy karboksylowej alifatycznych i aromatycznych aminokwasów.
Z drugiej strony jest w stanie działać w obecności niektórych substancji żrących, takich jak dodecylfate sodu (SDS), TRIS-HCL i EDTA, które są używane do pomocy denaturacji białek, powodując, że stracili natywną strukturę.
Jest to poprzedni krok w przygotowaniu białek do techniki elektroforezy. Zakres pH, na który działa K proteinsa, jest dość szeroki (2.0 do 12.0), z optymalnym pH między 7.5 do 12.0, a jego punkt izoelektryczny to 8.9. Jak widać, jest aktywny w stosunku do bardzo szerokiego zakresu pH.
Kolejną cechą wyróżniającą się w proteinazie K jest jej stabilność w obecności wysokich temperatur (50–60 ° C).
Aktywność enzymatyczna
Krotka K potrzebuje obecności jonu wapnia, chociaż nie wpływa on na jego aktywność, jeśli jest niezbędne do utrzymania jego stabilności.
Aby Krotka K do wykonania całkowitego trawienia podłoża konieczny jest przybliżony czas kontaktu od 5 minut do 2 godzin.
Jednak w tym sensie Daza i współpracownicy porównali czystość DNA uzyskanego w kilku czasach ekspozycji przeciwko proteinazie K i stwierdził, że przedłużona inkubacja (do 24 godzin) znacznie poprawia jakość DNA.
Teraz, w odniesieniu do stężenia stosowanego enzymu proteinazy K w różnych protokole, można powiedzieć, że jest bardzo zróżnicowany.
Można go stosować z bardzo niskich stężeń (5 µg/ml) do 500 µg/ml stężenia. Ale najczęstsze stężenia pracy wahają się między 50-100 μg /ml, szczególnie w przypadku trawienia białka i nukleasów. Chociaż do obróbki tkankowej wymagane jest stężenie 2 mg/ml.
Może ci służyć: Easmotherium sibiricum: Charakterystyka, siedlisko, skamielinyAplikacje
Ich aplikacje są bardzo szerokie i można je podsumować w następujący sposób:
-Jest stosowany w trawieniu białka i ekstrakcji DNA kilkoma metodami, takimi jak: solanie, PK-SDS, cetylistektylo amoniowe (CTAB), zmodyfikowany octan potasu i estrakcja jodku sodu.
-Inaktywacja nukleaz (RNASA i DNASA).
-W technice hybrydyzacji In situ (Jego), aby pomóc uwolnić kwas nukleinowy, oprócz eliminowania niepożądanych białek.
-Modyfikacja białka.
-Na poziomie badań, w różnych badaniach.
Zalety proteinazy K
Przeprowadzono różne badania porównawcze między technikami ekstrakcji DNA, które wykorzystują proteinazę K, z innymi, które go nie używają i wszystkie stwierdzają, że istnieją większe korzyści, gdy stosuje się enzym. Wśród zalet można wspomnieć:
-Uzyskuje się DNA o wysokiej jakości, wysokiej jakości i czystości.
-Wyekstrahowane DNA jest stabilne przez okres do 3 miesięcy.
DNA ekstrahowane można zastosować w następujących technikach: Southern blot, reakcja łańcuchowa polimerazy (PCR), elektroforeza,.
Białka K odporne na proteinazę
Różne badania stwierdzono, że prions (toksyczne anomalne białka PRPSC różnią się od białek PRPC (natywne) poprzez oporne na działanie kainazy k, podczas gdy PRPC są wrażliwe na ich działanie.
Inni autorzy opisali, że w strukturze PRPSC istnieją wrażliwe porcje, a inne odporne na proteinazę K. Jednak obie strony są równie toksyczne i zaraźliwe.
Z drugiej strony Bastian i współpracownicy w 1987 roku wyizolowali 4 białka z 28, 30, 66 i 76 kDa z rodzaju Spiroplasma mirum. Wszystko okazało się odporne na działanie proteinazy K, a także miały reakcję krzyżową z pewnymi prionami.
Może ci służyć: chemotoxisWiadomo, że gatunek ten może powodować ważne zaćmy i uszkodzenia neurologiczne oraz ze względu na naukowe ustalenia Bastian, między innymi, próbował odnosić się do tego mikroorganizmu z przenoszącymi się gąbczastymi encefalopatiami.
Jednak etiologia tej zwyrodnieniowej patologii neurologicznej pozostaje obecnie przypisana prionom.
W tym sensie kamerdyner i współpracownicy w 1991 r Mycoplasma hyorhinis. Ten patogen wpływa na świnie, infekując ich tkanki, ale w tym przypadku nie doszło do reakcji krzyżowej z testowanymi więzieniami.
Konieczne są dalsze badania w celu wyjaśnienia wielu niewiadomych w tym względzie.
Bibliografia
- Bastian F, Jennings R i Gardner W. 1987. Surowica odpornościowa do scrapie białko włóknistego z reakcją krzyżową Spiroplasma miruM Białka fibrylowe. J. Clin. Mikrobiol. 25: 2430-2431.
- Daza C, Guillen J, King J, Ruiz V. Ocena metody ekstrakcji i oczyszczania DNA z tkanki mięśniowej ustalonej w formaldehydzie niezidentyfikowanych zwłok. Med, 2014; 22 (1): 42-49,
- Butler G, Kotani H, Kong L, Frick M, Evancho S, Stanbridge E i McGarrity G. Identyfikacja i charakterystyka białek opornych na białko K u członków Mollicutes klasy. Infekcja i odporność, 1991, 59 (3): 1037-1042
- López M, Rivera M, Viettri M, Lares M, Marocoima A, Herrera L i in. Porównanie dwóch protokołów ekstrakcji DNA Trypanosoma cruzi uprawiane w ośrodku axhenicznym. Obrót silnika. Peru. Med. Do potęgi. Zdrowie publiczne 2014; 31 (2): 222-227. Dostępne na: Scielo.org
- Jiménez G, Villalobos M, Jiménez E i Palma W. Określenie skuteczności pięciu protokołów ekstrakcji DNA z parafowanego materiału do badań molekularnych. Rev Méd Medic Costa rica. 2007; 1 (1): 10-19.
- « Flora i fauna głównych gatunków Santiago del Estero
- Zaprogramowana historia starzenia się, typy, konsekwencje »

