Okresowe właściwości elementów i ich cech

- 1764
- 388
- Matylda Duda
Okresowe właściwości elementów Są to te, które definiują swoje zachowanie fizyczne i chemiczne z perspektywy atomowej i których wielkości, oprócz liczby atomowej, umożliwiają klasyfikację atomów.
Ze wszystkich właściwości są one charakteryzowane, jak sama nazwa wskazuje, ponieważ są okresowe; Oznacza to, że jeśli badana jest tabela okresowa, można certyfikat, że jego wielkości są zgodne z trendem, który pokrywa się i powtarza się z uporządkowaniem elementów w okresach (rzędach) i grupach (kolumny).
 Wewnętrzna okresowość części elementów stolika okresowej. Źródło: Gabriel Bolívar.
Wewnętrzna okresowość części elementów stolika okresowej. Źródło: Gabriel Bolívar. Na przykład, jeśli podróżujesz okresowym okresem, a właściwość maleje wraz z wielkością z każdym elementem, to samo wydarzy się we wszystkich okresach. Z drugiej strony, jeśli zejdzie z grupy lub kolumny, zwiększa swoją wielkość, to samo można się spodziewać dla innych grup.
I w ten sposób ich odmiany są powtarzane i dowodzone prostym trendem, który zgadza się z uporządkowaniem elementów dla ich liczb atomowych. Właściwości te są bezpośrednio odpowiedzialne za metaliczny lub niemetaliczny charakter pierwiastków, a także ich reaktywność, która pomogła je klasyfikować z większą głębokością.
Jeśli przez chwilę tożsamość elementów była nieznana i były one postrzegane jako dziwne „kule”, okresowy stół mógłby zostać odbudowany (z dużą ilością pracy), wykorzystując te właściwości.
W ten sposób rzekome kule uzyskałyby kolory, które pozwoliłyby im odróżnić je od siebie w grupach (obraz doskonały). Znając ich cechy elektroniczne, mogliby się zorganizować w okresach, a grupy zdradzałyby te, które mają taką samą liczbę elektronów walencyjnych.
Uczenie się i rozumowanie okresowe właściwości jest równe, aby wiedzieć, dlaczego elementy reagują w taki czy inny sposób; Wiedząc, dlaczego elementy metalowe są w niektórych regionach tabeli, a elementy nie -metalowe w innej.
[TOC]
Jakie są właściwości okresowe i ich cechy
-Radio atomowe
Podczas obserwowania sfery obrazu pierwszą rzeczą, którą można zauważyć, jest to, że nie wszystkie mają ten sam rozmiar. Niektóre są bardziej nieporęczne niż inne. Jeśli zaobserwowano z bardziej szczegółowymi szczegółami, okaże się, że rozmiary te różnią się posłusznie wzoru: w okresie maleje od lewej do prawej, a w grupie wzrasta od góry do dołu.
Powyższe można również powiedzieć w ten sposób: promień atomowy zmniejsza się w kierunku grup lub kolumn prawej i wzrasta w niższych okresach lub wierszy. Zatem promień atomowy jest pierwszą właściwością okresową, ponieważ jej zmiany są zgodne z wzorem w elementach.
Obciążenie jądrowe vs elektrony
Co to za wzór? W okresie elektrony atomowe zajmują ten sam poziom energii, który jest związany z odległością oddzielającą je od jądra. Kiedy przechodzimy z jednej grupy do drugiej (która jest taka sama jak podróżowanie po prawej), jądro dodaje zarówno elektrony, jak i protony w tym samym poziomie energii.
Może ci służyć: węgielDlatego elektrony nie mogą zajmować odległości od jądra, co zwiększa jego dodatnie obciążenie, ponieważ ma więcej protonów. W konsekwencji elektrony mają większą siłę przyciągania do jądra, przyciągając je coraz więcej wraz ze wzrostem liczby protonów.
Właśnie dlatego elementy na prawym końcu stolika okresowego (kolumny żółte i turkusowe) mają mniejsze radiotelefony atomowe.
Z drugiej strony, gdy „skacze” z jednego okresu do drugiego (co jest takie samo, aby powiedzieć, że grupa jest zstąpiona), nowe włączone poziomy energii pozwalają elektronom zajmować bardziej odległe przestrzenie w jądrze. Dalej jądro (z większą liczbą protonów) przyciąga je z mniejszą siłą; A zatem radia atomowe rosną.
Radia jonowe
Radia jonowe są posłuszne wzór podobny do radiotelefów atomowych; Jednak nie zależą one tak bardzo od jądra, ale ile elektronów lub mniej ma atom w odniesieniu do jego stanu neutralnego.
Kationy (na+, AC2+, Do3+, Być2+, Wiara3+) Wykazują dodatnie obciążenie, ponieważ straciły jeden lub więcej elektronów, a zatem jądro przyciąga je z większą siłą, ponieważ jest między nimi mniej odpychania. Rezultat: kationy są mniejsze niż atomy, z których pochodzą.
I dla anionów (lub2-, F-, S2-, Siema-) Przeciwnie, wykazują obciążenie ujemne, ponieważ ma on jeden lub więcej nadmiaru elektronów, zwiększając ze sobą swoje odpychanie powyżej przyciągania, które wywiera jądro. Wynik: aniony są większe niż atomy, z których pochodzą (niższy obraz).
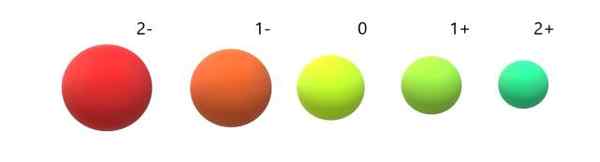 Zmienność radia jonowych w odniesieniu do atomu neutralnego. Źródło: Gabriel Bolívar.
Zmienność radia jonowych w odniesieniu do atomu neutralnego. Źródło: Gabriel Bolívar. Można zauważyć, że anion 2- jest najbardziej obszerny ze wszystkich, a kation 2+ najmniejszy. Radia rosną, gdy atom jest naładowany ujemnie, i umów się na pozytywne obciążenie.
-Elektronialiczność
Kiedy pierwiastki mają małe radiotelefony atomowe, nie tylko ich elektrony są bardzo przyciągane, ale także elektrony sąsiednich atomów, gdy tworzy wiązanie chemiczne. Ta tendencja do przyciągania elektronów innych atomów w związku jest tak zwana elektrooniczność.
Ten, który atom jest mały, nie oznacza, że będzie bardziej elektroonywalny. Jeśli tak, pierwiastki helu i wodoru byłyby najbardziej elektrowni atomów. Hel do miejsca, w którym pokazała nauka, nie stanowi kowalencyjnego związku; I wodór, ledwo ma pojedynczy proton w jądrze.
Może ci służyć: siarczek miedzi: struktura, właściwości, zastosowaniaGdy radia atomowe są duże, jądra nie mają wystarczającej wytrzymałości, aby przyciągnąć elektrony innych atomów; Dlatego najbardziej elektroonegatywne elementy to te o niewielkim promieniu atomowym i większej liczbie protonów.
Ponownie, ci, którzy doskonale spełniają te cechy, są elementami nie -metalowymi blokiem p okresu okresowego; Są to te należące do grupy 16 lub tlenu (O, S, SE, TE, PO) i grupy 17 lub fluoryn (F, Cl, Br, I, At).
Tendencja
Według wszystkiego powiedziane, najwięcej elektroungatywnych elementów znajdują się szczególnie w prawym górnym rogu okresowego tabeli; mając fluor jako element, który prowadzi listę najbardziej elektrowni.
Ponieważ? Bez uciekania się do skal elektroungatyczności (Pauling, Mulliken itp.), fluoror, chociaż jest większy niż neon (szlachetny gaz z okresu), pierwszy może tworzyć łącza, a drugi nie. Ponadto, ze względu na swój niewielki rozmiar, jego jądro ma wiele protonów i tam, gdzie jest fluor, nastąpi moment dipolowy.
-Postać metaliczna
Jeśli pierwiastek ma promień atomowy w porównaniu z promieniami tego samego okresu, a także jest niewielki elektroonywa, jest to metal i ma wysoki charakter metaliczny.
Jeśli wrócimy do głównego obrazu, czerwone i zielonkawe kule, podobnie jak szary, odpowiadają elementom metalowym. Metale mają unikalne cechy, a stąd właściwości okresowe z właściwościami fizycznymi i makroskopowymi materii zaczynają się splecione.
Elementy o wysokim metalicznym charakterze charakteryzują się ich stosunkowo dużymi atomami, łatwe do utraty elektronów, ponieważ jądra ledwo mogą ich przyciągnąć.
W rezultacie łatwo utleniają lub tracą elektrony, aby utworzyć kationy, m+; Nie oznacza to, że wszystkie kationy są metaliczne.
Tendencja
W tym momencie możesz przewidzieć, jak zmienia się charakter metaliczny w tabeli okresowej. Jeśli wiadomo, że metale mają duże radia metalowe i że istnieje również niewiele elektroony, należy oczekiwać najcięższych elementów (niższych okresów), być najbardziej metalicznym; i lżejsze elementy (górne okresy), najmniej metaliczny.
Podobnie, charakter metaliczny zmniejsza się, im bardziej elektroongenacyjny element jest wytwarzany. Oznacza to, że zwiedzanie okresów i grup po prawej stronie stolika okresowego, w ich wyższych okresach, spełni najmniej metalowe elementy.
Dlatego charakter metaliczny wzrasta poprzez zejście przez grupę i maleje do prawej do prawej w tym samym okresie. Wśród elementów metalowych mamy: Na (sod), Li (lit), MG (magnez), BA (bar), Ag (srebrny), Au (złoto), PO (Polonio), PB (ołów), CD (kadm ), Do (aluminium) itp.
Może ci służyć: Pojęcie wrzenia: koncepcja, obliczenia i przykłady-Energia jonizacji
Jeśli atom ma duży promień atomowy, oczekuje się, że jego jądro nie utrzymuje elektronów w znacznej wytrzymałości w najbardziej zewnętrznych warstwach. W związku z tym wyeliminowanie ich z atomu w fazie gazowej (zindywidualizowane) nie będzie wymagało dużo energii; To jest energia jonizacyjna, EI, niezbędna do odebrania elektronu.
Równa się również powiedzieć, że to energia należy dostarczyć w celu przezwyciężenia siły przyciągania jądra atomu lub jonu gazowego na jego najbardziej zewnętrznym elektronie. Im mniejszy atom i bardziej elektroujemnie, tym niższa jest jego; To jest twoja tendencja.
Poniższe równanie ilustruje przykład:
Na (g) => na+(g) + e-
Niezbędne do osiągnięcia nie jest tak wielkie w porównaniu z drugą jonizacją:
Na+(g) => na2+(g) + e-
Ponieważ w Na+ Pozytywne ładunki dominują, a jon jest mniejszy niż neutralny atom. W konsekwencji jądro Na+ przyciąga znacznie większą siłę do elektronów, więc wymaga znacznie większego.
-Powinowactwo elektroniczne
I wreszcie istnieje okresowa własność powinowactwa elektronicznego. Jest to trend energetyczny, który ma atom elementu fazowego gazu do zaakceptowania elektronu. Jeśli atom jest mały i ma rdzeń o dużej sile przyciągania, łatwo będzie zaakceptować elektron, tworząc stabilny anion.
Im bardziej stabilny anion w odniesieniu do jego neutralnego atomu, tym większe jego elektroniczne powinowactwo. Jednak w grę wchodzą również odpychanie między tymi samymi elektronami.
Na przykład azot ma większe powinowactwo elektroniczne niż tlen. Wynika to z faktu, że ich trzy elektrony 2p są zniknięte i zmniejszają się mniej ze sobą i przychodzącym elektronem; Podczas tlenu istnieje para sparowanych elektronów, które wywierają większy odpychanie elektroniczne; A na fluorku są dwie pary.
Z tego powodu mówi się, że trend w zakresie powinowactwa elektronicznego jest znormalizowany z trzeciego okresu stolika okresowego.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Prof. ORTEGA GRACIELA m. (1 kwietnia 2014). Okresowe właściwości elementów. Kolor ABC. Źródło: ABC.com.Py
- Chemia librettexts. (7 czerwca 2017 r.). Właściwości okresu elementów. Odzyskane z: chem.Librettexts.org
- Helmestine, Anne Marie, pH.D. (2 stycznia 2019). Okresowe właściwości elementów. Odzyskane z: Thoughtco.com
- TOPPR. (S.F.). Właściwości elementów okresu. Odzyskane z: toppr.com /
- Okresowe właściwości żywiołów: Podróż przez stół to podróż przez chemię. [PDF]. Odzyskane z: COD.Edu

