Formuły procesu izobarycznego, równania, eksperymenty, ćwiczenia

- 5023
- 1405
- Eugenia Czapla
W proces izobaryczny, presja P systemu pozostaje stały. Prefiks „ISO” pochodzi z greckiego i służy do oznaczenia, że coś pozostaje stałe, podczas gdy „baros”, również z greckiego, oznacza wagę.
Procesy izobaryczne są bardzo własne zarówno w zamkniętych pojemnikach, jak i w otwartych przestrzeniach, ponieważ jest łatwe do zlokalizowania ich w naturze. Dzięki temu rozumiemy, że zmiany fizyczne i chemiczne są możliwe na ziemskich reakcjach powierzchniowych lub chemicznych w otwartych pojemnikach na atmosferę.
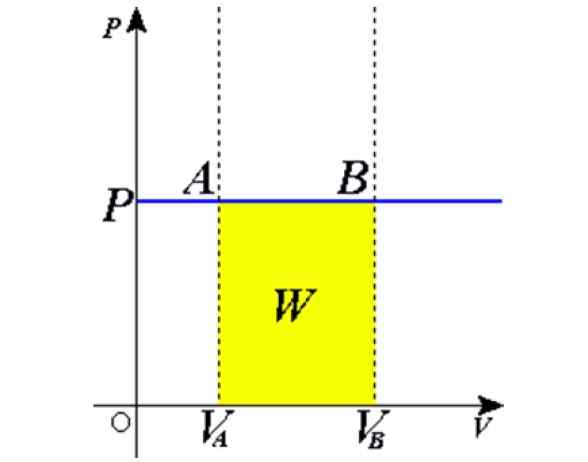 Rysunek 1. Proces izobaryczny: Niebieska pozioma linia to izobara, co oznacza stałe ciśnienie. Źródło: Wikimedia Commons.
Rysunek 1. Proces izobaryczny: Niebieska pozioma linia to izobara, co oznacza stałe ciśnienie. Źródło: Wikimedia Commons. Niektóre przykłady uzyskuje się przez ogrzewanie na słońcu balon pełen powietrza, gotowanie, gotowanie lub zamarzanie wody, pary wytwarzane w kotłach lub proces podnoszenia balonu na gorące powietrze. Później wyjaśnimy te sprawy.
[TOC]
Wzór i równania
Wyprowadzimy równanie dla procesu izobarycznego, zakładając, że badany system jest idealnym gazem, dość odpowiednim modelem dla prawie każdego gazu w mniej niż 3 atmosferze ciśnieniowe. Idealne cząstki gazu poruszają się losowo, zajmują całą objętość przestrzeni, która je zawiera bez interakcji.
Jeśli idealny gaz zablokowany w cylindrze dostarczonym z ruchomym tłokiem może się powoli rozszerzać, można założyć, że przez cały czas jego cząsteczki są w równowadze. Następnie gaz wywiera na tłok obszarowy DO siła F Ogrom:
F = p.DO
Gdzie P To ciśnienie gazowe. Siła ta wywiera pracę, tworząc nieskończenie małe przemieszczenie Dx W tłoku podanym przez:
dw = fdx = pa.Dx
Jak produkt ADX Jest to różnica głośności DV, Więc DW = PDV. Pozostaje zintegrowanie obu stron z początkowego objętości VDO Aż do ostatecznego tomu VB Aby uzyskać całkowitą pracę wykonaną przez gaz:


[TOC]
Eksperymenty
Opisana sytuacja jest weryfikowana eksperymentalnie konfigurowanie gazu w cylindrze dostarczonym z ruchomym tłokiem, jak pokazano na rysunkach 2 i 3. Tłok jest umieszczony na tłoku, którego waga jest skierowana, podczas gdy gaz wywiera siłę dzięki ciśnieniu P, które wytwarza na tłok.
Może ci służyć: Imantacja: co polega na metodzie i przykładach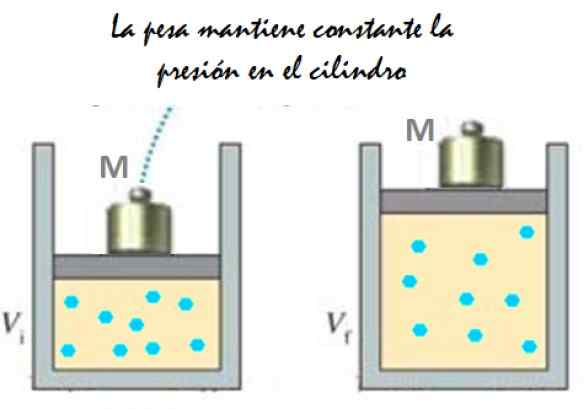 Rysunek 2. Eksperyment, który polega na rozszerzeniu stałego ciśnienia gazu. Źródło: f. Zapata.
Rysunek 2. Eksperyment, który polega na rozszerzeniu stałego ciśnienia gazu. Źródło: f. Zapata. Ponieważ tłok jest w stanie swobodnie poruszać się, objętość, którą zajmuje gaz może się zmieniać bez problemu, ale ciśnienie pozostaje stałe. Dodanie ciśnienia atmosferycznego Pbankomat, To również wywiera siłę, masz:
Mg - p.A + pbankomat . A = stała
Dlatego: p = (mg/a) + pbankomat Nie różni się, chyba że m, a wraz z nią modyfikowana waga. Dodając ciepło do cylindra, gaz rozszerzy się zwiększenie jego objętości lub będzie kurczywa się podczas wydobywania ciepła.
Procesy izobaryczne w gazie idealnym
Idealne równanie stanu gazu wiąże zmienne ważności: ciśnienie P, objętość V i temperatura T:
P.V = n .R.T
Tutaj n reprezentuje liczbę moli, a r jest stałą gazów idealnych (ważnych dla wszystkich gazów), która jest obliczana przez pomnożenie stałej Boltzmanna przez liczbę Avogadro, co daje:
R = 8.31 J/mol K
Gdy ciśnienie jest stałe, równanie stanu można zapisać jako:
V/t = nr/p
Ale NR/P jest stałe, ponieważ N, R i P są. Kiedy więc system przechodzi z jednego stanu 1 do innego stanu 2, pojawia się następujący odsetek, znany również jako prawo Karola:
V1/T1 = V2/T2
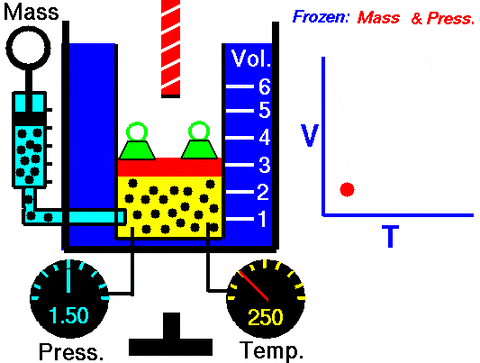 Rysunek 3. Animacja, która pokazuje rozszerzenie gazu stałego ciśnienia. Po prawej wykres objętości w zależności od temperatury, która jest linią. Źródło: Wikimedia Commons. Centrum Badawcze Glenn NASA [domena publiczna].
Rysunek 3. Animacja, która pokazuje rozszerzenie gazu stałego ciśnienia. Po prawej wykres objętości w zależności od temperatury, która jest linią. Źródło: Wikimedia Commons. Centrum Badawcze Glenn NASA [domena publiczna]. Zastąpienie W = pΔv, Prace wykonane w celu przejścia ze stanu 1 do 2, pod względem stałych i zmienności temperatury, łatwa do pomiaru za pomocą termometru:
W1 → 2 = nr (t2 - T1) = nr.Δt
Z drugiej strony pierwsze prawo termodynamiki stwierdza, że:
∆U = Q - w
Oznacza to, że dodanie do gazu pewna ilość ciepła q, energia wewnętrzna ∆U wzrasta, a wibracje jego cząsteczek wzrastają. W ten sposób gaz rozszerza się i wykonuje pracę, wypierając tłok, jak powiedzieliśmy wcześniej.
W idealnym gazie monoatomicznym i zmienności energii wewnętrznej ∆U, która obejmuje zarówno energię kinetyczną, jak i energię potencjalną jego cząsteczek, wynosi:
∆U = (3/2)Nr δt
Wreszcie łączymy w jednym wyrażeniach, które uzyskaliśmy:
Q = ∆U + w = (3/2)Nr δt + Nr∆T = (5/2) Nr δt
Alternatywnie, które można przepisać pod względem masy M, różnicy temperatury i nowej stałej nazywanej Ciepło specyficzne Pod stałym ciśnieniem, skrócone CP, którego jednostki to J/mol K:
Może ci służyć: Venus (planeta)Q = m cP ∆t
Przykłady
Nie wszystkie procesy izobaryczne są przeprowadzane w zamkniętych pojemnikach. W rzeczywistości występują niezliczone procesy termodynamiczne wszelkiego rodzaju ciśnienia atmosferycznego, więc procesy izobaryczne są bardzo częste. Obejmuje to zmiany fizyczne i chemiczne na powierzchni Ziemi, reakcje chemiczne w pojemnikach otwartych i wiele więcej.
Aby procesy izobaryczne miały miejsce w systemach zamkniętych, konieczne jest, aby ich granice były wystarczająco elastyczne, aby umożliwić zmiany objętości bez zmiennego ciśnienia.
Tak stało się w eksperymencie tłokowym, które łatwo się poruszyło, gdy gaz rozszerzył się. To samo dzieje się, otaczając gaz na imprezach lub balon na gorące powietrze.
Tutaj mamy kilka przykładów procesów izobarycznych:
Gotuj wodę i gotuj
Gotowa woda do herbaty lub sosów gotowania w otwartych pojemnikach są dobrymi przykładami procesów izobarycznych, ponieważ wszyscy rozwijają się pod ciśnieniem atmosferycznym.
Podczas podgrzewania wody, wzrostu temperatury i objętości oraz w przypadku kontynuowania ciepła, w końcu osiągnięto temperaturę wrzenia, w którym następuje zmiana fazy wodnej. Podczas gdy tak się dzieje, temperatura pozostaje również stała 100 ° C.
Zamrozić wodę
Z drugiej strony, zamarzająca woda jest również procesem izobarycznym, niezależnie od tego, czy odbywa się ona w jeziorze zimą, czy w lodówce domowej.
Rozgrzej balon pełen powietrza na słońce
Innym przykładem procesu izobarycznego jest zmiana objętości napompowanego powietrza balonu, gdy jest on narażony na słońce. Pierwsza rzecz rano, kiedy nie jest bardzo gorąco, glob ma określoną głośność.
W miarę upływu czasu i wzrośnie temperatura glob ogrzewa również zwiększenie jego objętości i wszystko to dzieje się pod stałym ciśnieniem. Materiał globowy jest dobrym przykładem granicy wystarczająco elastycznej, aby powietrze w środku, po podgrzewaniu, rozszerza się bez modyfikowania ciśnienia.
Doświadczenie można również przeprowadzić, dostosowując glob bez nowości w szczycie szklanej butelki pełnej jednej trzeciej wody, która jest podgrzewana do Marii Bio of Mary. Gdy tylko woda zostanie podgrzewana, balon jest natychmiast napompowany, ale należy zachować ostrożność, aby nie podgrzewać się zbytnio, aby nie wybuchła.
Balon aerostatyczny
Jest to pływający statek bez napędu, który wykorzystuje prądy powietrzne do transportu ludzi i przedmiotów. Globe jest zwykle wypełnione gorącym powietrzem, które jest chłodniejsze niż otaczające powietrze, wznosi.
Może ci służyć: Triple PointPodczas gdy prądy powietrzne bezpośrednio do globu, ma palniki, które są aktywowane w celu podgrzewania gazu, gdy chcesz wznieść się lub utrzymać wysokość, i są dezaktywowane podczas schodzenia lub lądowania. Wszystko to dzieje się pod ciśnieniem atmosferycznym, przypuszczano, że stała na pewnej wysokości niedaleko powierzchni.
 Rysunek 4. Balony na gorące powietrze. Źródło: Pixabay.
Rysunek 4. Balony na gorące powietrze. Źródło: Pixabay. Kotły
W kotłach para jest wytwarzana przez podgrzewanie wody i utrzymanie stałego ciśnienia. Następnie ta para wykonuje użyteczne zadanie, na przykład wytwarzając energię elektryczną w roślinach termoelektrycznych lub działając w innych mechanizmach, takich jak lokomotywy i pompy wodne.
Rozwiązane ćwiczenia
Ćwiczenie 1
Istnieje 40 litrów gazu w temperaturze 27 ° C. Znajdź wzrost objętości podczas dodawania ciepła izobárrycznie, aż osiągnie 100 ° C.
Rozwiązanie
Prawo Karola służy do określenia ostatecznego objętości, ale uwaga: temperatury należy wyrazić w Kelvin, po prostu dodaj 273 K do każdego:
27 ºC = 27 + 273 K = 300 K
100 ° C = 100 + 273 K = 373 K
Z:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ° C (40 l/300 K) = 49.7 l
Wreszcie wzrost objętości to v2 - V1 = 49.7 l - 40 l = 9.7 l.
Ćwiczenie 2
5 jest dostarczanych 5.00 x 103 J z energii do idealnego gazu do robienia 2.00 x 103 J pracy nad twoim środowiskiem w procesie izobarycznym. Jest proszony o znalezienie:
a) Zmiana energii wewnętrznej gazu.
b) Zmiana objętości, jeśli teraz energia wewnętrzna maleje o 4.50 x 103 J i 7 są wydalane.50 x 103 J systemu, biorąc pod uwagę stałe ciśnienie 1.01 x 105 Rocznie.
Rozwiązanie
Używany ∆U = Q - w a wartości podane w instrukcji zostały zastąpione: Q = 5.00 x 103 J i W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Dlatego wewnętrzna energia gazu wzrasta o 3.00 x 103 J.
Rozwiązanie b
Zmiana objętości znajduje się w wykonanej pracy: W = p∆V:
∆U = q - w = q - P∆V
Oświadczenie potwierdza, że energia wewnętrzna zmniejsza się, zatem: ∆U= -4.50 x 103 J. Mówi nam również, że wydalona jest pewna ilość ciepła: q = -7.50 x 103 J. W obu przypadkach znak ujemny reprezentuje spadek i stratę:
-4.50 x 103 J = -7.50 x 103 J - p∆V
Gdzie P = 1.01 x 105 Rocznie. Ponieważ wszystkie jednostki znajdują się w systemie międzynarodowym, zmiana objętości jest jasna:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Rocznie) = -2.97 x 10-2 M3
Ponieważ zmiana objętości jest ujemna, oznacza to, że objętość zmniejszyła się, to znaczy system zakontraktowany.
Bibliografia
- Byjou's. Proces izobaryczny. Odzyskane z: Byjus.com.
- Cengel i. 2012. Termodynamika. 7. edycja. McGraw Hill.
- Proces XYZ. Dowiedz się więcej o procesie izobarycznym. Odzyskany z: 10 proces.X i Z.
- Serway, r., Vulle, c. 2011. Podstawy fizyki. 9na ed. Cengage Learning.
- Wikipedia. Prawa gazowe. Odzyskane z: jest.Wikipedia.org.
- « 14 Eksperymenty psychologiczne z bardzo kontrowersyjnymi ludźmi
- Koncepcja, typy i przykłady zysku »

