Adiabatyczne typy procesów, przykłady, ćwiczenia rozwiązane
- 4683
- 821
- Paweł Malinowski
A Proces adiabatyczny Jest to ten, w którym nie ma wymiany ciepła między systemem a jego otoczeniem, albo dlatego, że występuje on w medium izolacyjnym, albo dlatego, że mija bardzo szybko. Oznacza to, że w otoczeniu systemu jest to część badanego wszechświata, zmiany temperatury nie powinny być postrzegane, ale tylko działać.
Jest to jeden z podstawowych procesów termodynamiki. W przeciwieństwie do innych procesów (izokorycznych, izobarycznych i izotermicznych), żadna z jego zmiennych fizycznych nie pozostaje stała; to znaczy wielkości ciśnienia, objętości, temperatury i entropii zmieniają się w miarę ewolucji procesu adiabatycznego.
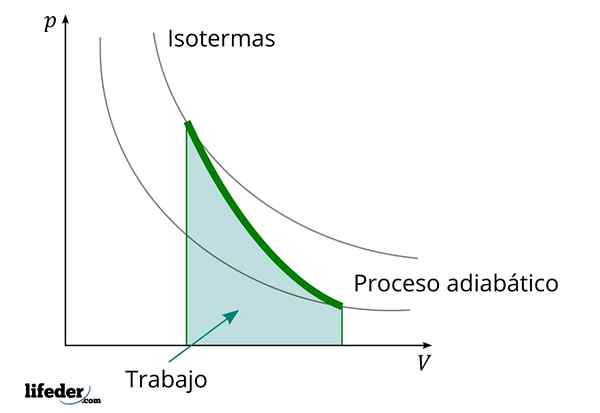
 Podczas procesu adiabatycznego, w którym zwiększa się objętość, wewnętrzna energia substancji, którą praca zmniejsza
Podczas procesu adiabatycznego, w którym zwiększa się objętość, wewnętrzna energia substancji, którą praca zmniejsza Inną ważną cechą procesów adiabatycznych jest to, że przeprowadzają one lub spożywają pracę proporcjonalnie do zmienności energii wewnętrznej ich systemów; W tym przypadku cząsteczek jego cząsteczek w fazie gazowej. Można to wykazać dzięki pierwszemu prawowi termodynamiki.
W życiu codziennym ten rodzaj procesu obejmuje przede wszystkim zjawiska geofizyczne i, do pewnego stopnia, funkcjonowanie tłoków w silnikach Diesla. Transfer ciepła często zapobiega użyciu medium izolacyjnego, ale to szybkość tych procesów pozwala na ich prawdziwy rozwój.
[TOC]
Odwracalne i nieodwracalne procesy adiabatyczne
Odwracalny
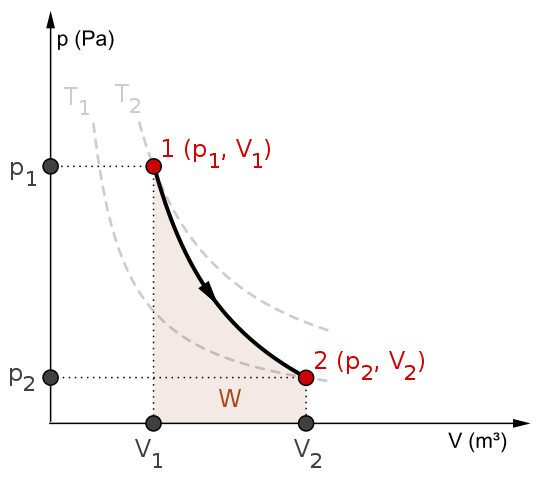 Schemat P-V i praca w procesie adiabatycznym. Źródło: Mikerun/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)
Schemat P-V i praca w procesie adiabatycznym. Źródło: Mikerun/CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Procesy adiabatyczne mogą być odwracalne lub nieodwracalne. Jednak te pierwsze istnieją tylko jako teoretyczne narzędzia do badania tego drugiego. Zatem odwracalne procesy adiabatyczne obejmują idealne gazy i brak tarcie i innej ewentualności, które powodują przenoszenie ciepła między systemem a jego otoczeniem.
Rozważmy na przykład schemat P-V dla odwracalnego procesu adiabatycznego z góry. T1 oraz T2 odpowiadają dwóm izotermom, na których presja P i tomy V systemu różnią się.
Wśród stanów (str1, V1) I p2, V2) Wykonuje się odwracalne rozszerzenie adiabatyczne, ponieważ przechodzimy od tomu V1 do jednego v2, większy, po kierunku strzałki.
W ten sposób system chłodzi, ale bez przestrzegania zachowania izoterm. Obszar pod krzywą odpowiada pracy W, której wartość jest dodatnia, ponieważ jest to rozszerzenie.
W tym procesie entropia pozostaje stała i dlatego mówi się, że jest izontropika. Matematyczne przetwarzanie tej odwracalności generuje zestaw równań, z którymi można ocenić inne systemy.
Może ci służyć: komórki elektrolityczneNieodwracalny
Nieodwracalne procesy adiabatyczne, w przeciwieństwie do tych odwracalnych, nie są graficzne na schematach p-v z ciągłymi, ale kropkowanymi liniami, ponieważ tylko stany końcowe i początkowe mają swoje zmienne (p, v i t) dobrze zdefiniowane. Procesy te obejmują rzeczywiste gazy, więc równanie gazów idealnych i ich pochodnych nie ma bezpośrednio zastosowania do nich.
Przechodzą szybko, zapobiegając przenoszeniu ciepła między systemem a jego otoczeniem. Również w nich entropia wzrasta, jak stwierdzono w drugim prawie termodynamiki.
Przykłady procesów adiabatycznych
 Pojemność izolacyjna, taka jak ta prezentowana przez termos, jest jednym z kluczowych czynników procesu rozwijania adiabatycznego
Pojemność izolacyjna, taka jak ta prezentowana przez termos, jest jednym z kluczowych czynników procesu rozwijania adiabatycznego Niektóre przykłady procesów adiabatycznych zostaną wymienione poniżej.
Ekspansja i zrozumienie
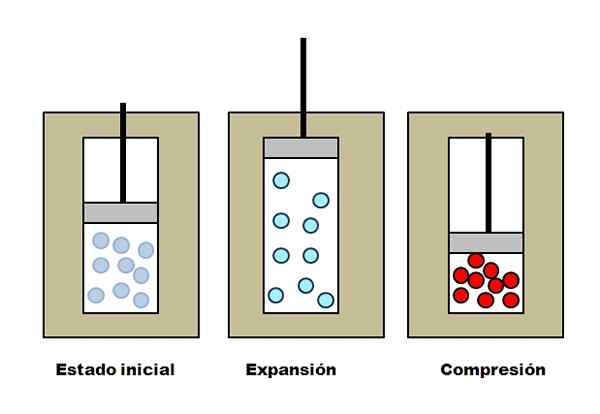 Rozszerzenie i zrozumienie adiabatyczne. Źródło: Gabriel Bolívar.
Rozszerzenie i zrozumienie adiabatyczne. Źródło: Gabriel Bolívar. Załóżmy, że trzy kamizelki izolacyjne zawierające przedziały pełne gazem. W stanie początkowym tłok nie ma nacisku na gaz. Następnie tłok może wzrastać, co zwiększa objętość, w której mogą się poruszać cząsteczki gazowe, powodując spadek energii wewnętrznej; A zatem spadek temperatury.
Wręcz przeciwnie do kompresji adiabatycznej: tłok wykonuje prace nad gazem, zmniejszając objętość, którą mogą zajmować jego cząsteczki. Tym razem energia wewnętrzna wzrasta, co sugeruje również wzrost temperatury, którego ciepło nie może rozproszyć się w kierunku otoczenia z powodu kamizelki izolacyjnej.
Magma Ascent
Kanały, w których magma unosi się wewnątrz wulkanu, mówią jako pożywka izolacyjna, która zapobiega przenoszeniu ciepła między magmą a atmosferą.
Rozprzestrzenianie się dźwięku
Gazy są zakłócane i rozszerzone zgodnie z falą dźwiękową bez chłodzenia lub gorącego powietrza, które je otaczają.
Efekt Foehna
Efekt Foehna jest przykładem procesów adiabatycznych w dziedzinie geofizyki. Masy powietrza wznoszą się w kierunku górnej części góry, w której odczuwają mniejszą presję, więc ich cząsteczki rozszerzają się i chłodzą, powodując powstanie chmury.
Jednak ledwo opadają po drugiej stronie góry, ciśnienie wzrasta, a zatem cząsteczki są ściśnięte i podnoszą temperaturę, powodując zniknięcie chmury.
Może ci służyć: chlorobenzen (C6H5CL)W poniższym filmie zjawisko to można docenić:
Rozwiązane ćwiczenia
Wreszcie, kilka ćwiczeń zostanie rozwiązanych. Ważne jest, aby mieć pod ręką następujące równania:
Δu = Q - w (pierwsze prawo termodynamiki)
Ale brak transferu ciepła, q = 0 y:
Δu = - w (1)
To jest: jeśli praca W jest pozytywna, δu jest ujemna i odwrotnie. Z drugiej strony mamy również:
W = -NCVΔT (2)
Że po zastosowaniu idealnego równania GASE (PV = NRT) oraz zastępowanie i rozwiązywanie dla t2 oraz T1 będziemy mieli:
W = (cV/R) (p1V1 - P2V2) (3)
Będąc wartością R równą 0.082 L · atm/mol · k lub 8.314 J/mol · k
W procesach adiabatycznych ważne jest znanie związku CP/CV znany jako γ:
γ = cP/CV (4)
Który umożliwia ustanowienie relacji T-V i P-V:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
A także przybliżone ciepły CP i CV Różnią się w zależności od tego, czy gazy są monoatomiczne, dwuatomiczne itp.
Ćwiczenie 1
Gaz wykonuje 600 J pracy za pomocą izolowanego przedziału. Jaka jest zmiana energii wewnętrznej? Czy temperatura zmniejsza lub rośnie? I biorąc pod uwagę, że jest to gaz monoatomiczny, również oblicz γ.
Dane:
W = +600J
Δu = ¿?
γ =?
W pracach jest pozytywna, ponieważ gaz pracuje nad otoczeniem. Będąc w izolowanym przedziale, q = 0, a zatem będziemy mieli równanie (1):
Δu = - w
To znaczy δu jest równe:
Δu = - (+600J)
= -600J
Co oznacza, że wewnętrzna energia gazu zmniejszyła się o 600 j. Jeśli δu maleje, podobnie jest temperatura, więc gaz chłodzi się w wyniku wykonania pracy.
Ponieważ ten gaz jest monoatomiczny,
CV = 3/2 r
CP = 5/2 r
I bycie
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 lub 1.66
Ćwiczenie 2
W pojemniku 7 moli O2 Zostały skompresowane z objętości 15 litrów do 9 litrów. Wiedząc, że początkowa temperatura wynosiła 300 K, oblicz: praca wykonana na gazie.
Dane:
N = 7 moli lub2
T1 = 300 K
V1 = 15 l
V2 = 9 l
W = ¿?
To nieodwracalne rozumienie adiabatyczne. Mamy dwa równania do rozwiązania W:
W = -NCVΔT (2)
W = (cV/R) (p1V1 - P2V2) (3)
Naciski mogą je obliczyć, ale aby zaoszczędzić czas, lepiej kontynuować z pierwszym z równań:
Może ci służyć: woda destylowanaW = -NCVΔt
= -NCV (T2-T1)
Potrzebujemy cV oraz T2 Aby określić w. Tlen, będący gazem dwuatomicznym, ma cV równe 5/2 R:
CV (ALBO2) = 5/2 r
= 5/2 (8.314 J/mol · k)
= 20.785 J/mol · k
Musimy obliczyć t2. Zwracamy się do równania (5):
T1V1γ-1 = T2V2γ-1
Ale zanim go użył, musisz określić najpierw CP i γ:
CP (ALBO2) = 7/2 r
= 7/2 (8.314 J/mol · k)
= 29.099 J/mol · k
Bycie γ równym:
γ = cP/CV
= (29.099 J / mol · k) / 20.785 J/mol · k
= 1.4
Więc możemy to oczyścić2 Z równania (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300k) (15l)1.4-1] / (9L)1.4-1
= 368.01 k
I wreszcie rozwiązujemy dla W:
W = -NCVΔt
= -(7 mol o2)( 20.785 J/mol · k) (368.01 K - 300 K)
= -9895.11 J O -9.895 kJ
Ćwiczenie 3
Neon pojemnik rozszerza się adiabatyczny i początkowo w temperaturze pokojowej (t = 298 tys.) Od 12 l do 14 l. Wiedząc, że jego początkowe ciśnienie wynosiło 3 atm, jaka będzie praca wykonana przez gaz?
Dane:
T1 = 298 K
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Równanie (3) pozwala nam określić w wartości ciśnień:
W = (cV/R) (p1V1 - P2V2)
Ale brakuje nam CV I p2.
Końcowe ciśnienie można obliczyć za pomocą równania (6):
P1V1γ = P2V2γ
Bycie γ równym CP/CV. Ponieważ neon jest gazem monoatomicznym, mamy jego wartości CP i CV Mają odpowiednio 5/2R i 3/2R. Obliczamy wtedy γ:
γ = cP/CV
= (5/2R)/(3/2r)
= 5/3 lub 1.66
Oczyszczamy p2 Z równania (6):
P2 = (Str1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
A praca będzie równa:
W = (cV/R) (p1V1 - P2V2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 PA/1 ATM) (0.001 m3/L) (KJ/1000 J)
= 2.49 kJ
Współczynniki konwersji stosuje się do konwersji l · atm A Pa · m3, co odpowiada 1 J. Neon gaz rozszerza się, więc jego ciśnienie zmniejsza się, a podczas pracy nad otoczeniem jest to pozytywne. Ponadto jego energia wewnętrzna δu zmniejsza się, a także temperatura, chłodzenie w procesie ekspansji.
Bibliografia
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Iran. Levine. (2009). Zasady fizykochemii. Szósta edycja. MC Graw Hill.
- Wikipedia. (2020). Proces adiabatyczny. Źródło: w:.Wikipedia.org
- Jones, Andrew Zimmerman. (18 sierpnia 2020). Themodynamika: proces adiabatyczny. Odzyskane z: Thoughtco.com
- Devoe Howard i Neils Tom. (9 sierpnia 2020). Zmiany adiabatyczne. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Jaki jest mechaniczny odpowiednik ciepła?
- Historia Maderismo, ideologia, przedstawiciele, konsekwencje »

