Zasada Le Châtelier

- 2421
- 299
- Herbert Wróblewski
Co to jest zasada Le Châtelier?
On Zasada Le Châtelier Ogólna zasada przewiduje efekt, jaki mają różne czynniki wpływające na równowagę chemiczną. W szczególności pomaga przewidzieć, w którym kierunku reakcja, która jest w równowadze, porusza.
Ta zasada określa, że:
„Gdy układ, który jest w równowadze, podlega zaburzeniu lub napięciu zewnętrznym, system reaguje w kierunku, który pozwala mu częściowo przeciwdziałać takim zakłóceniu”.
Zakłócenia są dobrze zrozumiane:
- Zmiana stężenia któregokolwiek z odczynników.
- Zmiana stężenia któregokolwiek z produktów.
- Zmiany presji.
- Zmiany objętości.
- Zmiana temperatury
Kiedy pojawiają się zmiany, jak wspomniano, jedna z dwóch reakcji, bezpośrednia lub odwrotna, jest faworyzowana w odniesieniu do drugiej, tak że system reaguje w tym sensie, zmierzając w kierunku nowego stanu równowagi.
Jest to podobne do korekt dokonywanych przez balanser na linie. Kiedy grawitacja hala z jednej strony, równowaga reaguje, przesuwając się na przeciwną stronę. Mówimy, że jego równowaga się poruszyła, ponieważ wciąż jest w równowadze (nie upada), ale teraz ma inną pozycję.
Następnie zobaczymy, w jaki sposób zasada Le Châtelier jest używana do przewidywania kierunku, w którym system będzie reagował, cierpiąc na różne rodzaje napięć lub zaburzeń, takie jak: zmiany stężenia, objętości, ciśnienia i temperatury.
Wpływ zmian w stężeniu
Załóżmy, że mamy następującą reakcję w równowadze:
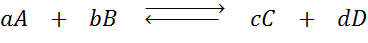
Jeśli zmienimy stężenie któregokolwiek z zaangażowanych gatunków (A, B, C lub D), zasada Le Châtelier przewiduje, że system zareaguje na przeciwdziałanie tej zmianie albo zużywa nadmiar dodanej lub odzyskując wyeliminowaną ilość. Można podać 4 różne sytuacje:
1. Zwiększone stężenie odczynników
Jeśli zwiększymy stężenie odczynnika, na przykład, zgodnie z zasadą Le Châtelier, system zareaguje, aby pochłonąć dodatkową nadmiar. Oznacza to, że będzie reagować bezpośrednio (od lewej do prawej), ponieważ ten kierunek jest pochłonięty.
W takim przypadku mówi się, że reakcja bezpośrednia jest uprzywilejowana i że równowaga przeniesiona do produktów, ponieważ w nowej równowadze koncentracja produktów jest większa niż w pierwotnej równowagi.
Może ci służyć: separacja magnetyczna2. Zwiększone koncentracja produktów
Jeśli zwiększymy stężenie produktu, na przykład C, system zareaguje odwrotnie, aby zużywać nadmiar C dodany (to znaczy od prawej do lewej).
W tym przypadku mówi się, że reakcja odwrotna jest faworyzowana i że równowaga przesuwa się w kierunku odczynników.
3. Zmniejszenie stężenia odczynnika
Spadek stężenia ma odwrotny wpływ na wzrost wspomnianego stężenia. Jeśli wycofamy się z pożywki, zmniejszając jego stężenie, system zareaguje na lewą (z odwrotną), aby przeciwdziałać zmianie. Równowaga przesuwa się w kierunku odczynników.
4. Zmniejszenie stężenia produktów
Jeśli zmniejszymy stężenie C lub D, układ zareaguje bezpośrednio, aby zastąpić zmniejszone stężenie (to znaczy od lewej do prawej). Równowaga zmierza w kierunku produktów.
Przykład:
Określ efekt dodania większej liczby jonów tiocianate (SCN-) W poniższej równowagi chemicznej wiedząc, że iloczyn prawa jest intensywny czerwony, a żelazo (III) jest żółty.
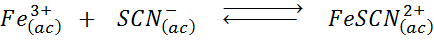
Rozwiązanie: W tym przypadku dodajemy tiocianato, który jest odczynnikiem, więc równowaga musi poruszać się w prawo, zwiększając stężenie kompleksu, a zatem intensywność czerwonego koloru w roztworze.
Wpływ zmian objętości i ciśnienia
Zmiany objętości i ciśnienia nie wpływają znacząco na reakcje w równowadze w stanie ciekłym lub stałym, ale mogą wpływać na zmiany stwierdzone w stanie gazowym. Wynika to z faktu, że w przypadku gazów stężenie jest proporcjonalne do ciśnienia, jak przewiduje prawo gazów idealnych.
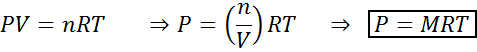
Zwiększenie ciśnienia gazu utrzymującego stałą temperaturę jest równoważne zmniejszenie jego objętości, więc efekt obu zakłóceń będzie taki sam.
Jeśli całkowite ciśnienie wzrośnie do reakcji bilansu w równowadze (lub zmniejszamy jego objętość), układ zareaguje ponownie, próbując ponownie zmniejszyć takie ciśnienie, więc równowaga przejdzie do miejsca, w którym istnieje mniejsza ilość cząsteczek cząstek gazowych.
Może ci służyć: chromatografia warstwy: charakterystyka, do czego służy W reakcji między azotem i wodorem z utworzeniem amoniaku spożywane są 4 cząsteczki sody i wytwarzane są tylko dwa, więc wzrost ciśnienia wypiera równowagę w kierunku tworzenia najbardziej amoniaku
W reakcji między azotem i wodorem z utworzeniem amoniaku spożywane są 4 cząsteczki sody i wytwarzane są tylko dwa, więc wzrost ciśnienia wypiera równowagę w kierunku tworzenia najbardziej amoniaku Jeśli w reakcji są one spożywane i wytwarzana jest taka sama liczba cząsteczek gazu, wówczas zmiany objętości i ciśnienia nie wpłyną na równowagę.
Z drugiej strony, jeśli modyfikujemy tylko ciśnienie częściowe któregokolwiek z gazów, efekt jest taki sam jak zwiększenie lub zmniejszenie stężenia wspomnianych gatunków.
Przykład:
Biorąc pod uwagę reakcję rozkładu tetroksydu Dyitrogen w równowadze:
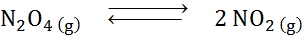
Określ wpływ objętości zmniejszania, zwiększające ciśnienie.
Rozwiązanie: Jeśli zwiększymy całkowite ciśnienie systemu lub zmniejszymy jego objętość, równowaga przesuwa się w kierunku odczynników, ponieważ w tym kierunku występuje spadek netto cząsteczek gazu (2 i 1) 1), co pozwala przeciwdziałać wzrostowi ciśnienia.
Wpływ zmian temperatury
Wpływ temperatury na bilans chemiczny różni się od innych czynników, które do tej pory widzieliśmy. W poprzednich przypadkach nowa równowaga jest uzyskiwana po zakłóceniu, ale utrzymywana jest ta sama stała równowagi. Jednak jeśli temperatura się zmieni, stała równowagi zmieni się.
Aby wiedzieć, jak zmienia się stała równowagi wraz z temperaturą, należy znać znak entalpii reakcji:
- Jeśli reakcja uwalnia ciepło, to znaczy jest egzotermiczny, jej entalpia jest ujemna, a stała równowagi zmniejsza się wraz ze wzrostem temperatury. W takich przypadkach równowaga porusza się w przeciwnym kierunku w kierunku odczynników.
- Jeśli reakcja pochłania ciepło, to znaczy jest endotermiczna, jej entalpia jest dodatnia i dzieje się odwrotnie.
Pamiętanie o efekcie temperatury jest łatwe, jeśli uważamy ciepło za odczynnik, który występuje w przypadku reakcji egzotermicznych i jest spożywana w przypadku endotermicznej. Zwiększenie temperatury byłoby jak „dodaj” ciepło do systemu i ochłodzenie byłoby równoważne z jego usunięciem.
Tak więc, jeśli reakcja jest egzotermiczna, a temperatura jest zwiększona, byłoby to jak dodanie iloczyn reakcji, więc równowaga porusza się w przeciwnym kierunku, w kierunku odczynników, a jeśli chłodzi odwrotnie.
Może ci służyć: kwas panie: co to jest, struktura, synteza, właściwościZ drugiej strony, jeśli reakcja jest endotermiczna, a temperatura jest zwiększona, byłoby to jak dodanie odczynnika, więc równowaga przesuwa się w kierunku produktów, podczas gdy spadek temperatury ma odwrotny efekt.
Przykład:
Reakcja rozkładu n2ALBO4 Ma entalpię reakcji reakcji +58,0 kJ/mol. W tym kierunku równowaga się porusza, jeśli temperatura zostanie zmniejszona?
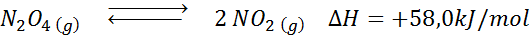
Rozwiązanie: Ponieważ entalpia jest pozytywna, reakcja jest endotermiczna. Z tego powodu chłodzenie będzie sprzyjać odwrotnej reakcji, a równowaga przejdzie w kierunku odczynników, to znaczy w kierunku tworzenia większej liczby n2ALBO4.
Wpływ katalizatorów, inhibitorów i substancji obojętnych
Katalizatory i inhibitory wpływają na prędkość, z jaką reakcje występują, ale wpływają one zarówno na reakcję bezpośrednią, jak i pośredniej. Z tego powodu nie wpływają one na stan równowagi.
Z drugiej strony dodanie substancji obojętnej jako gazu, który nie reaguje z żadną z odczynników lub produktów, nie wpłynie na reakcję bezpośrednią lub bezpośrednią, więc będzie miała jakikolwiek wpływ na równowagę.
Zastosowanie zasady Le Châtelier
Zrozumienie tej zasady jest bardzo przydatne, ponieważ pozwala nam manipulować stanem równowagi reakcji na naszą wygodę.
W tych przypadkach, w których jesteśmy zainteresowani.
To znaczy:
- Dodaj duże ilości odczynników, jeśli są one ekonomiczne.
- Wycofaj produkt w miarę postępu reakcji, aby utrzymać system w stałym stanie napięcia, zawsze starając się osiągnąć równowagę reagując bezpośrednio.
- Zwiększyć temperaturę w przypadku reakcji endotermicznych.
- Zwiększ presję na te reakcje, w których konsumowane są więcej cząsteczek gazowych niż występują.
Możemy również chcieć zminimalizować ilość produktu utworzonego przez niechcianą reakcję. W takich przypadkach robimy odwrotnie.
Przykład zastosowania zasady Le Châtelier
W syntezie organicznej zasada le châtelier jest stale stosowana do poprawy reakcji reakcji.
Na przykład w reakcjach odwodnienia alkoholu do środowiska dodawane są wysuszniki pochłaniające wodę utworzoną podczas reakcji. Zmniejsza to stężenie wspomnianego produktu, co wypiera równowagę w stosunku do produktów.

